फ़ॉस्फ़ोरस एक तत्व हैं, जो आर्वत सारणी के पंचम समूह के अ उपवर्ग में आता है। इसका परमाणु भार ३१, परमाणु संख्या १५, संयोजकताएँ ३ तथा ५ और संकेत फा (P) है। इस तत्त्व की खोज सर्वप्रथम हैंबर्ग के निवासी ब्रैंड (Brand) ने १६६९ ई. में की। ब्रैंड ने मूत्र के वाष्पन तथा आसवन से इस तत्व की प्राप्ति की। इस तत्व का फ़ॉस्फ़ोरस नाम पड़ने का कारण यह है कि ग्रीक भाषा में संयुक्त शब्द फ़ॉस्फ़ोरस (फ़ॉस = प्रकाश+फ़ेरो = मै वहन करता हूँ) का अर्थ होता है 'मै प्रकाश वहन करता हूँ'। पहले तो यह नाम उन सभी पदार्थों के लिए प्रयुक्त होता था जो अंधकार में चमकते थे, किंतु बाद में यह तत्वविशेष के लिए प्रयुक्त होने लगा।
उपस्थिति - यद्यपि यह तत्व प्रकृति में अत्यंत विस्तीर्ण है, तथापि असंयुक्त रूप में कदाचित् ही पाया जाता है, क्योंकि इसकी बंधुता ऑक्सीजन के लिए विशेष होती है। यही कारण है कि फ़ॉस्फ़ोरस शीघ्र ही ऑक्सीकृत के यौगिकों के रूप में, विशेषतया खनिज फ़ॉस्फ़ेटों के रूप में पाया जाता है। ये खनिज फ़ास्फ़ेट मुख्यतया कैल्सियम फ़ॉस्फ़ेट यौगिक के बने होते हैं। इसके अतिरिक्त मिट्टियों, नदियों या सागरों के जलों में भी अल्प मात्रा में फ़ॉस्फ़ोरस यौगिक रूप में वर्तमान रहता है। विभिन्न प्रकार के पौधों तथा सभी पशुओं में इसकी उपस्थिति वांछनीय है। प्रकृति में फ़ॉस्फ़ोरस का एक ऐसा संतुलित चक्र चलता रहता है, जिससे भूमि और पशु-पौधों में पारस्परिक आदान प्रदान बना रहता है। अच्छी फसलों के उत्पादन के लिए भूमि में फ़ॉस्फ़ोरस का होना नितांत आवश्यक है। भूमि की सतह में ०.११% फ़ॉस्फ़ोरस वर्तमान है और उसमें पाए जानेवाले प्रमुख तत्वों की क्रमसूची में इसका बारहवाँ स्थान है।
अपर रूप (Allotropic forms) - फ़ॉस्फ़ोरस चार अपर रूपों में वर्तमान रह सकता है : पीत या श्वेत फ़ॉस्फ़ोरस, लाल फ़ॉस्फ़ोरस, बैंगनी फ़ॉस्फ़ोरस और श्याम फ़ॉस्फ़ोरस। किंतु इनमें से दो अपर रूप पीत और लाल ही महत्वपूर्ण हैं। जब फ़ॉस्फ़ोरस के वाष्प को संघनित होने दिया जाता है तब पीत फ़ॉस्फ़ोरस बनता है, किंतु गलनांक तक यह अत्यंत अस्थायी रहता है। केवल लाल फ़ॉस्फ़ोरस ही स्थायी होता है। इसकी प्राप्ति पीत फ़ॉस्फ़ोरस को अधिक देर तक प्रकाश में रहने देने, या उसमें विद्युन्मोचन कराने, अथवा वायु की अनुपस्थिति में फ़ॉस्फ़ोरस को २५०° सें. ताप पर गरम करने से होती है। व्यापारिक स्तर पर लाल फ़ॉस्फ़ोरस का निर्माण पीत फ़ॉस्फ़ोरस को एक लौह बरतन में २४०° सें. पर गरम करके किया जाता है। लाल फ़ॉस्फ़ोरस को कुछ लोग अक्रिस्टली फ़ॉस्फ़ोरस भी कहते हैं। इसकी खोज सर्वप्रथ १८४५ ई. में श्रोटर ने की। लाल फ़ॉस्फ़ोरस को ३६०° सें. ताप पर बंद नली में अधिक देर तक गर्म करते रहने से श्याम फ़ॉस्फ़ोरस बनता है। यह अत्यंत स्थायी रूप है।
पीत फ़ॉस्फ़ोरस ठोस होता है, किंतु हवा में रखते ही उसपर श्वेत अपारदर्शी परत पड़ जाती है, जिससे यह रंगहीन अथवा श्वेत फ़ॉस्फ़ोरस कहलाता है। इसे अष्टफलकीय, सामान्य अथवा अधात्वीय फ़ॉस्फ़ोरस भी कहते हैं। यह मोम की भाँति कोमल होने के कारण सरलता से चाकू द्वारा काटा जा सकता है। प्रकाश में खुला रख देने पर लाल फ़ॉस्फ़ोरस के बनने से इसका रंग बदल जाता है। इसका आपेक्षिक घनत्व १.८३, गलनांक ४४.४ सें. और क्वथनांक २८७° सें. है। खुली तथा आर्द्र हवा में यह शीघ्र ही जल उठता है। ऐसे वातावरण में इसका ज्वलन ताप ३०° सें. है, किंतु शुष्क हवा में यह ताप ऊँचा होता है। इस निम्न ज्वलनताप के कारण शरीर की ऊष्मा से ही इसके ज्वलित हो जाने का भय रहता है। इस कारण इसे कभी भी हाथ से नहीं छूना चाहिए। इसी ज्वलनशीलता के कारण इसका संग्रह पानी के भीतर किया जाता है, जिसमें यह अविलेय है। कार्बन डाइ-सल्फाइड में यह पूर्ण रीति से विलेय है। इसके अतिरिक्त ऐल्कोहॉल, ईथर, बेंज़ीन, ग्लिसरीन, ऐसीटिक अम्ल, ज़ाइलीन, मेथिल आयोडाइड, स्टियरिक अम्ल तथा तारपीन में भी यह विलेय है।
जब पीत फ़ॉस्फ़ोरस को अँधेरे में छोड़ दिया जाता है, तब उसमें से पीले हरे रंग का प्रकाश निकलता है। यह प्रकाश प्राचीन काल से साधारण जनों को आकर्षित करता रहा है। रात्रि के समय श्मशानों में प्राय: ऐसा प्रकाश देखा जाता है। इस प्रकाश का कारण फ़ॉस्फ़ोरस हाइड्राइड (फ़ास्फ़ीन) का निर्माण है, जो हवा में ऑक्सीजन के रहने से प्रज्वलित होता रता है। कुछ लोग का विचार है कि फ़ॉस्फ़ोरस हवा के ऑक्सीजन के संयोग से त्रि-ऑक्साइड बनाता है और साथ ही साथ ओज़ोन भी बनता है, जो फ़ॉस्फ़ोरस के दहन और प्रकाश में योग देते हैं। खुली हवा में आर्द्र फ़ॉस्फ़ोरस भी ऑक्सीकृत होता रहता है जिसमें श्वेत धूम्र निकलता है, जो लहसुन की तरह महकता है। अधिक ताप पर यह तुरंत अग्नि पकड़ लेता है और फ़ॉस्फ़ोरस पेंटॉक्साइड बनाता है। यह क्लोरीन, गंधक, नाइट्रिक अम्ल तथा कॉस्टिक सोडा के साथ क्रिया करके विभिन्न यौगिक बनाता है। यह अत्यंत विषैला होता है।
लाल फ़ॉस्फ़ोरस सिंदूरी लाल रंग का होता है और इस रंग के कारण ही उसका यह नामकरण हुआ है। यह पीले फ़ॉस्फ़ोरस की अपेक्षा कम सक्रि और साधारण ताप पर अधिक स्थायी होता है। इसका आपेक्षिक घनत्व २.३ तथा गलनांक ५९०° सें. (४३ वायुमंडल दाब पर) है। २००° सें. के नीचे इसका वाष्पन संभव नहीं है। अँधेरे में खुला छोड़ देने पर न तो यह प्रदीप्त होता है और न इसमें किसी प्रकार का परिवर्तन होता है। न तो यह विषैला होता है और न घर्षण से शीघ्र ही ज्वलित होनेवाला। हवा में २६०° सें. तक गरम करने पर ही यह आग पकड़ता है।
श्याम रंग के कारण फ़ॉस्फ़ोरस का एक अपर रूप श्याम फ़ॉस्फ़ोरस कहलाता है। इसका आपेक्षिक घनत्व २.७ है, जो सभी अपर रूपों के आपेक्षिक घनत्व से अधिक है। इसका कोई व्यापारिक महत्व नहीं है।
बैगनी फ़ॉस्फ़ोरस का आपेक्षिक घनत्व २.३६, गलनांक ६००° सें. तथा ज्वलन ताप २६०° सें. है। यह विलायकों में अविलेय है।
पारस्परिक भिन्नताओं के होते हुए भी चारों अपर रूपों के अणुओं में कोई भेद नहीं। सभी के समान भार लेकर जलाने पर समभार में फ़ॉस्फ़ोरस पेंटॉक्साइड बनता है।
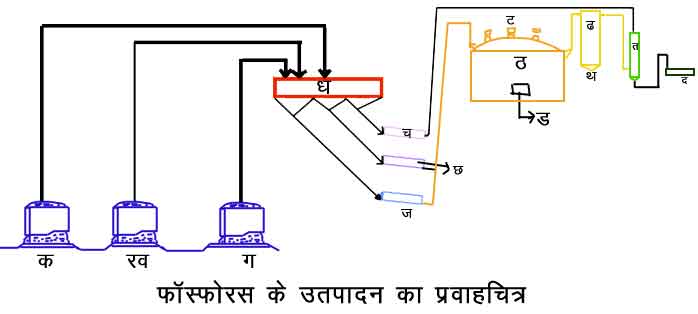
निर्माण - पहले जानवरों की अस्थियों से फ़ॉस्फ़ोरस प्राप्त किया जाता था। इस विधि में जिलेटिन रहित अथवा भुनी हुई अस्थियों को

चित्र. फॉस्फोरस के उत्पादन का प्रवाहचित्र
क. फ़ॉस्फ़ेट; ख. कोक; ग. बालू; घ. धान कीप (hoppers); च. ग्रंथिकरण भट्टी; छ. तथा ज. शुष्कीकारक; झ. उपजात कार्बन मोनॉक्साइड गैस, जो ईधंन के काम आती है; ट. विद्युदग्र; ठ. विद्युद्भट्ठी; ड. धातुमल तथा लोह फ़ॉस्फ़ोरस; ढ. गैस शोधक; त. संघनित्र; थ. धूल तथा द. फ़ॉस्फ़ोरस संग्रह टंकी।
सल्फ्यूरिक अम्ल के साथ एक बड़े हौज में अभिक्रिया कराने के पश्चात् तरल पदार्थ को छानकर उसे वाष्पीकृत किया जाता है। और जब इस तरल पदार्थ का आपेक्षिक घनत्व १.४५ हो जाता है, तब इसमें २०% कोयला या जला हुआ पत्थर का कोयला (कोक) मिलाकर इसे छिछले कड़ाहों में गरम किया जाता। जब इसमें छह प्रतिशत आर्द्रता रह जाती है, तब इसे बंद मुँह के बरतनों में रखकर भट्टी में इतना गरम किया जाता है कि लाल हो जाए। इस प्रकार लगातार तीन चार दिनों तक गरम करते रहने से वर्तमान फ़ॉस्फ़ोरस आसुत होकर एक दूसरे बर्तन में पानी में एकत्र होता रहता है, जहाँ से इसे निकालकर पुनरासुत किया जाता है, तब शुद्ध फ़ॉस्फ़ोरस मिलता है। किंतु यह अत्यंत कष्टकारक विधि है। अधिक लागत पर भी इसमें फ़ॉस्फ़ोरस की अत्यंत अल्प प्राप्ति हो पाती है; इसलिए अब विद्युत् भट्टियों एवं वात्या-भट्टियों का प्रयोग होने लगा है और फ़ॉस्फ़ोरस का व्यापारिक निर्माण भी सुगम एवं सस्त हो गया है। इस नवीन प्रणाली में चट्टानीय फ़ॉस्फ़ेट, सिलिका तथा कार्बन (कोक) के मिश्रण को लेकर भट्टी में अपचायक वातावरण में पिघलाया जाता है और फिर फ़ॉस्फ़ोरस के वाष्प को एकत्र कर उसे नाना प्रकार के यौगिकों में परिवर्तित किया जाता है। इस विधि में सल्फ्यूरिक अम्ल की आवश्यकता नहीं पड़ती, साथ ही इससे अधिक फ़ॉस्फ़ोरस की प्राप्ति भी होती है।
फ़ॉस्फ़ोरस के यौगिक - फ़ॉस्फ़ोरस, ऑक्सीजन, हाइड्रोजन, क्लोरीन, गंधक तथा धातुओं के साथ मिलकर क्रमश: ऑक्साइड, हाइड्राक्साइड, क्लोराइड, सल्फाइड तथा फ़ॉस्फ़ाइड यौगिक बनाता है। ऑक्साइडों को पानी में घुलाने से फ़ॉस्फ़ोरस के अम्लों की प्राप्ति होती है। ऑक्साइडों में फ़ॉस्फ़रस पेंटॉक्साइड, हाइड्राइड में फ़ॉस्फ़ीन फा हा३ (PH3), हेलाइडों में फ़ॉस्फ़ोरस पेंटाक्लोराइड फा क्लो५ (PCI5) सल्फाइड़ों में फ़ॉस्फ़ोरस पेंटासल्फाइड फा२ ग़ं५ या फा४ गं१० (P2 S5 or P4 S10) अधिक महत्व के हैं।
फ़ॉस्फ़ाइड - फ़ॉस्फ़ोरस अनेक धातुओं के संयोग से फ़ॉस्फ़ाइड बनाता है, किंतु गंधक की अपेक्षा धातुओं के लिए इसकी बंधुता कम है। फ़ॉस्फ़ाइडो में टिन और ताँबे के फ़ॉस्फ़ाइड केवल इन धातुओं और फ़ॉस्फ़ोरस के संयोग से ही बनते हैं। ये फ़ॉस्फ़ाइड पानी या अम्ल के साथ क्रिया करके फ़ॉस्फ़ीन या फॉस्फोनियम लवण बनाते हैं।
फ़ॉस्फ़ोरस के क्षार - रासायनिक दृष्टि से फ़ॉस्फ़ीन, अमोनिया के सदृश्य है और अमोनियम हाइड्रॉक्साइड की ही भाँति फ़ॉस्फ़ोनियम हाइड्रॉक्साइड नाम क्षार बनता है।
फ़ॉस्फ़ोरस के अम्ल - फ़ॉस्फ़ोरस के आठ अम्ल ज्ञात हैं, जिनमें से पाँच तो फ़ॉस्फ़ोरस ऑक्साइड तथा फ़ॉस्फ़ोरस पेंटॉक्साइड और जल के संयोग से बनते हैं। इनके नाम हैं : मेटाफ़ॉस्फ़ोरस, फ़ॉस्फ़ोरस, मेटाफ़ॉस्फ़ोरिक, पाइरोफॉस्फोरिक, तथा आर्थोफ़ॉस्फ़ोरिक अम्ल। इनके अतिरिक्त हाइपोफ़ॉस्फ़ोरस, पाइरोफ़ॉस्फ़ोरस तथा हाइपोफ़ॉस्फ़ोरस अम्ल हैं, जो फ़ॉस्फ़ोरसश् के ऑक्साइडों तथा जल की अभिक्रिया से नहीं प्राप्त होते। इन आठों अम्लों में आर्थोफ़ॉस्फ़ोरिक अम्ल की सर्वाधिक महत्वपूर्ण है, जिसका आण्विक सूत्र, हा३ फा औ४ (H3 P O4) इसके दो अणुओं में से एक अणु जल की हानि होने पर पाइरोफ़ॉस्फ़ोरिक अम्ल हा४ फा२ औ७ (H4 P2 O7,) तथा एक ही अणु में से एक अणु जल हानि से मेटाफ़ॉस्फ़ोरिक अम्ल हा फा औ३ (H P O3) बनते हैं। फ़ॉस्फ़ोरिक अम्ल त्रिक्षारकी होता है जिसके कारण तीन प्रकार के लवण, प्राथमिक, द्वितीयक तथा त्रितीयक, बनते हैं, जिन्हें फ़ॉस्फेट कहते हैं (देखें फ़ॉस्फ़ेट)। इस अम्ल का सबसे अधिक उपयोग कृत्रिम खाद या उर्वरकों के निर्माण में होता है।
इसके अतिरिक्त फ़ॉस्फ़ोरस अनेक यौगिक बनाता है, जैसे हाइपोफ़ॉस्फ़ेट फ़ॉस्फ़ेट तथा फ़ॉस्फ़ोप्रोटीन आदि।
प्रयोग - फ़ॉस्फ़ोरस एक आवश्यक तत्व है, जो फ़ॉस्फ़ेटश् के रूप में मनुष्यों और पशुओं के अस्थिनिर्माण में सहायक होता है। स्वास्थ्यरक्षा के लिए आवश्यक है कि शरीर में फ़ॉस्फ़ोरस का संतुलन स्थिर रहे। यही नहीं, शरीर में होनेवाली अनेक प्रतिक्रियाओं में भी फ़ॉस्फ़ोरस का महत्वपूर्ण हाथ रहता है। फ़ॉस्फ़ेट के रूप में फ़ॉस्फ़ोरस का सर्वाधिक प्रयोग भूमि को उपजाऊ बनाने के लिए उर्वरकों के रूप में होता है। अब तो के समस्थानिक फा३२ (p32) के ज्ञात हो जाने के कारण उसका उपयोग भूमि से पौधों द्वारा फ़ॉस्फ़ेट उर्वरकों के अवशोषण अध्ययन में होने लगा है।
श्वेत अथवा पीत फ़ॉस्फ़ोरस का उपयोग फ़ॉस्फ़ोरस कांस्य, फ़ॉस्फ़ोरस टिन, फ़ॉस्फ़ोरस ताँबा, जैसी मिश्रधातुओं के निर्माण तथा चूहों एवं अन्य हानिकारक कीटाणुओं की रोकथाम के लिए विषैले पदार्थों के बनाने में होता है। युद्ध के समय विस्फोटकों एवं धूम्र आवरणों के उत्पादन के लिए भी फ़ॉस्फ़ोरस का उपयोग होता है। पीत फ़ॉस्फ़ोरस अत्यंत विषैला होता है और ०.१ ग्राम से भी मनुष्य की मृत्यु हो जाती है। इसका धूम्र बड़ा घातक होता है। इससे नाक और जबड़े की अस्थियाँ सड़ जाती हैं। पहले पीत फ़ॉस्फ़ोरस का सर्वाधिक उपयोग दियासलाई के निर्माण में होता था और यही कारण है कि दियासलाई के कारखानों में काम करनेवाले कर्मचारी प्राय: उपर्युक्त रोग के शिकार हो जाते थे। जब से पीत फ़ॉस्फ़ोरस के स्थान पर लाल फ़ॉस्फ़ोरस का उपयोग दियासलाई के निर्माण में होने लगा, इस रोग का अंत हो गया है।
फ़ॉस्फ़ोरस के जिन यौगिकों का महत्वपूर्ण औद्योगिक उपयोग होता है, उनमें फ़ास्फ़ोरिक अम्ल तथा उसके व्युत्पन्नों को छोड़कर सल्फाइड तथा क्लोराइड विशेष रूप से उल्लेखनीय हैं। दियासलाई बनाने के लिए फ़ॉस्फ़ोरस सेल्क्वि सल्फाइड फा४ ग्रं३ (P4 S3) का बड़े पैमाने पर उपयोग होता है और फ़ॉस्फ़ोरस पेंटासल्फाइड फा४ ग्रं१० (P4 S10) का उपयोग कार्बनिक फ़ॉस्फ़ोरस-गंधक यौगिकों के निर्माण में होता है। ये यौगिक स्नेहक तैलों के गुणों में विशिष्टता लाने के लिए प्रयुक्त होते हैं। फ़ॉस्फ़ोरस पेंटाक्लोराइड के उपयोग से ऐल्कोहॉल और कार्बनिक अम्लों को उनके संगत क्लोराइडों में परावर्तित किया जाता है। ऑक्सीक्लोराइड का उपयोग रंगों और दवाओं के लिए होता है। युद्ध तथा औद्योगिक उपयोग के अतिरिक्त लाल फ़ॉस्फ़ोरस का सर्वाधिक उपयोग दियासलाइयों के ऊपर की घर्षण सतह के निर्माण में होता है (देखें दियासलाई)।
सं. ग्रं. - जे. डब्लू. मेलर : कॉम्प्रीहेन्सिव ट्रिटीज़ ऑन इनऑगैनिक ऐंड थ्योरेटिकल केमिस्ट्री। (शिवगोपाल मिश्र)