 |
 |
||||
 |
 |
||||
|
|
||||
|
|
परमाणु (Atom) शब्द भारतवर्ष में बहुत प्राचीन काल से प्रचलित हैं। वैशेषिक और न्यायदर्शन में परमाणु की चर्चा हुई है और कणाद इसके प्रतिपादक समझे जाते हैं। यूरोप में भी ईसा पूर्व चौथी और पाँचवीं शताब्दी में अरस्तू आदि ग्रीक और रोमन दार्शनिकों का विचार था कि द्रव्य का विभाजन करते करते एक ऐसा अंश प्राप्त होता है जिसका फिर विभाजन असंभव है। किंतु यह विचार केवल कल्पना मात्र ही था। यह किसी प्रत्यक्ष प्रेक्षित तथा पर आधारित नहीं था।
रासायनिक दृष्टि से डॉल्टन (Dalton) ने ही सर्वप्रथम १८०३ ई. में परमाणु की यह वैज्ञानिक परिभाषा प्रस्तुत की थी कि किसी तत्व के उस अल्पतम अंश को परमाणु कहते हैं, जो अकेला या अन्य परमाणुओं के साथ मिलकर रह सके। थोड़े बहुत सुधार के साथ आज भी उनकी मूल धारणाएँ सर्वमान्य हैं। द्रव्य दो प्रकार के होते हैं, तत्व (element) और यौगिक (compound)। तत्व के सूक्ष्मतम भाग को परमाणु कहते हैं। एक तत्व के समस्त परमाणु बिलकुल एक से होते हैं। उसका भार भी बराबर होता है। विभिन्न तत्वों के परमाणु विभिन्न प्रकार के होते हैं और उनके भार भी विभिन्न होते हैं। हाइड्रोजन, ऑक्सीजन, ताम्र, लोह, यूरेनियम आदि तत्व हैं। यौगिक पदार्थों के सूक्ष्मतम भाग को अणु (molecule) कहते हैं। प्रत्येक यौगिक के समस्त अणु भी बिल्कुल एक से होते हैं। प्रत्येक अणु दो या अधिक, एक से अथवा विभिन्न प्रकार के परमाणुओं के संयोजन से बनता है। यथा, जल यौगिक है; इसके अणु में एक परमाणु ऑक्सीजन का तथा दो परमाणु हाइड्रोजन के होते हैं। घनिष्ट संपर्क होने से अणु टूट सकते हैं और उनके परमाणुओं से नवीन प्रकार के अणु बन सकते हैं। इस घटना को रासायनिक क्रिया कहते हैं। इसके किसी भी परमाणु का नाश नहीं होता।
ये बातें निम्नलिखित प्रेक्षणलब्ध नियमों पर आधारित हैं :
 |
 |
||||
 |
 |
||||
|
|
||||
|
|
(क) स्थिर अनुपात नियम - इसके अनुसार प्रत्येक यौगिक में उसके अवयव तत्वों का अनुपात स्थिर रहता है, यथा जल में सदैव हाइड्रोजन ११.२% तथा ऑक्सीजन ८८.८% रहते हैं।
(ख) गुणित अनुपात के नियम - इसके अनुसार यदि दो तत्वों (क तथा ख) के कई यौगिक बनते हों तो उनमें क की एक ही मात्रा से संयोजित ख की मात्राएँ एक लघुतम मात्रा की पूर्णांक (integral) गुणज होती है। यथा फेरस ऑक्साइड और फेरिक ऑक्साइड में १ ग्राम ऑक्सीजन के साथ संयोजित लोह की मात्राएँ क्रमश: ३.४९ और २.३३ ग्राम होती हैं। ये संख्याएँ १.१६ की तिगुनी तथा दुगुनी हैं।
भौतिक विज्ञान की आधुनिक प्रगति के कारण न तो अब परमाणु अविभाज्य समझा जाता है ओर न एक तत्व के सब परमाणु एक से माने जाते हैं। फिर भी समस्त रसायन विज्ञान इन्हीं धारणाओं पर आज भी अवलंबित है।
परमाणु का व्यास - द्रव्य के समस्त भौतिक गुणों की व्याख्या जिस अणुगति सिद्धांत (Kinetic Theory) के द्वारा संभव हुई थी उसके अनुसार अणु और परमाणु निरंतर गतिशील होते हैं। गैस में तो वे अत्यंत तीव्र वेग से इधर उधर दौड़ते और आपस में टकराते रहते हैं। ठोस पदार्थों में वे अपने स्थान से हट तो नहीं सकते, किंतु बराबर कंपन करते रहते हैं। यदि परमाणु ठोस गोली की आकृति का मान लिया जाए, तो इस सिद्धांत के अनुसार उसका व्यास लगभग १०- ८ सेमीं. होना चाहिए। यह अनुमान अब भी सही समझा जाता है।
परमाणु का भार - यद्यपि रासायनिक उपायों से यह संभव नहीं था कि किसी भी अकेले एक परमाणु का भार नापा जा सके, फिर भी अनेक यौगिकों में तत्वों के अनुपातों का अध्ययन करके विभिन्न परमाणुओं के आपेक्षिक भार नाप लिए गए। इस कार्य में आवोगाद्री (Avogadro) की परिकल्पना (सन् १८११) से बड़ी सहायता मिली थी। इसके अनुसार समान दबाव तथा ताप पर समस्त गैसों के बराबर आयतनों में अणुओं की संख्या बराबर होती है। हाइड्रोजन का परमाणु सबसे हलका निकला और पहले इसी के भार को मात्रक मानकर अन्य परमाणुओं के आपेक्षिक भार व्यक्त किए गए थे। ये परमाणुभार (atomic weight) कहलाते हैं। आजकल इसका मात्रक बदलकर ऑक्सीजन के परमाणु के भार का १/१६वाँ अंश कर दिया गया है। इस हिसाब से अब हाइड्रोजन का परमाणुभार १.००८ है और ऑक्सीजन का १६.००० है।
अब कई ऐसे
उपाय भी मालूम
हो गए हैं जिनसे
अणुओं और परमाणुओं
की संख्या का ठीक
ठीक अनुमान किया
जा सकता है। इनके
द्वारा यह ज्ञात
हो गया है कि
यदि किसी यौगिक
का अणुभार भ हो
तो उस तत्व की भ
ग्राम मात्रा में
६.०२३´ १०२३ अणु होते
हैं। इस संख्या को
आवोगाद्री संख्या
कहते हैं। हाइड्रोजन
का अणुभार २.०१६ होता
है और उसके एक
अणु में दो परमाणु
होते हैं। अत: हाइड्रोजन
परमाणु का भार
हुआ =
![]() =
१.६६ ´ १०- २४
ग्राम।
=
१.६६ ´ १०- २४
ग्राम।
समस्थानिक (Isotope) - १९१९ ई. में ऐस्टन (Aston) ने ऐसा यंत्र तैयार किया था जिसमें चुंबकीय तथा वैद्युत् वलक्षेत्रों की सहायता से एक एक परमाणु का भार अलग अलग नापा जा सकता है। इसे द्रव्यमान-स्पेक्ट्रमलेखी (mass-spectrograph) कहते हैं। इससे पता चला कि प्रत्येक परमाणु का आपेक्षिक भार सर्वदा पूर्णांक ही होता है। जिन तत्वों का परमाणुभार पूर्णांक नहीं पाया गया था, वे वस्तुत: विभिन्न भारवाले परमाणुओं के मिश्रण होते हैं। यथा क्लोरीन के परमाणु दो प्रकार के होते हैं, जिनके भार क्रमश: ३५ तथा ३७ होते हैं। ये क्रमश: ३:१ के अनुपात में मिले रहते हैं। इसी कारण रासायनिक परमाणुभार ३५.४६ पाया गया था। यह औसत परमाणुभार था। एक ही तत्व के ऐसे विभिन्न भारवाले, किंतु अभिन्न रासायनिक गुणोंवाले, परमाणुओं को समस्थानिक कहते हैं, क्योंकि आवर्त सारणी में (देखें आवर्त सारणी) उनका एक ही स्थान होता है। किसी किसी तत्व में तो समस्थानिकों की संख्या ८ से १० तक पहुँच जाती है।
आवर्त सारणी (Periodic Table) - जब समस्त तत्वों को परमाणुभार के क्रम से एक सारणी में लिखा गया तब ज्ञात हुआ कि इस अनुक्रम में तत्वों के रासायनिक तथा भौतिक गुणों का कुछ सुनिर्दिष्ट नियमों के अनुसार आवर्तन होता है। इस दृष्टि से ये अनुक्रम बड़ा महत्वपूर्ण है। इसमें तत्व के क्रमिक स्थान की सूचक संख्या का नाम परमाणु क्रमांक (atomic number) रख दिया गया है। वस्तुत: अब यह क्रमांक दूसरे ही दृष्टिकोण द्वारा नियत किया जाता है (नीचे देखें), जिसके कारण कुछ तत्वों के क्रमांक भार के अनुक्रम के अनुसार नहीं माने जाते, यथा निकल तथा कोबाल्ट के परमाणुभार क्रमश: ५८.६८ तथा ५८.९७ हैं, तथापि उनके क्रमांक क्रमश: २८ तथा २७ हैं।
परमाणु की सरंचना (Structure) - रासायनिक दृष्टि से परमाणु अविभाज्य होने पर भी कई विद्वानों की, विशेषत: प्राउट (Prout) की १९वीं शताब्दी के प्रारंभ में, यह धारणा थी कि समस्त तत्वों के परमाणु विभिन्न संख्यक हाइड्रोजन परमाणुओं के संयोजन से बने हैं, क्योंकि उनका अनुमान था कि सभी का परमाणुभार हाइड्रोजन के परमाणुभार का पूर्णांक अपवर्त्य होता है। किंतु जब यह पाया गया कि कई परमाणुभार पूर्णांक नहीं होते (यथा क्लोरीन का ३५.५) तब इस पकिल्पना को छोड़ देना पड़ा।
जब १८९६ ई. में जे.जे. टॉमसन (J.J. Thomson) ने कैथोड किरणों का आविष्कार किया तब यह प्रमाणित हो गया कि परमाणु अविभाज्य नहीं हैं और प्रत्येक परमाणु के ऋण विद्युत् से आविष्ट इलेक्ट्रॉन नामक अत्यंत क्षुद्र कणिकाएँ विद्यमान रहती हैं, जिनका भार हाइड्रोजन परमाणु के १/१८६०वें भाग के बराबर होता है। उस समय वह ठीक ठीक समझ में नहीं आया था कि परमाणु में धन विद्युत् कहाँ रहती है। फिर भी टॉमसन ने यह धारणा बनाई कि प्रत्येक परमाणु में इलेक्ट्रॉनों की संख्या परमाणु क्रमांक के बराबर होती है और इसके द्वारा उन्होंने आवर्त सारणी की तथा तत्वों के अनेक गुणों की अच्छी व्याख्या कर दी थी। १९११ ई. में रदरफ़र्ड (Rutherford) ने रेडियोऐक्टिव पदार्थों से उत्सर्जित ऐल्फा कणों (alpha particles) की बौछार के द्वारा प्रयोगत: प्रमाणित कर दिया कि परमाणु के धन विद्युत् प्राय: १०- १३ सेंमी. व्यासवाली अत्यंत छोटी कणिका के रूप में रहती है। इस कणिका नाम नाभिक या न्यूक्लियस (nucleus) है (देखें नाभिक)। इसका व्यास परमाणु व्यास से प्राय: एक लाख गुणा होता है, किंतु परमाणु का समस्त भार इसी में निहित रहता है। यदि इलेक्ट्रॉन के आवेश को विद्युत् का मात्रक माना जाए तो स्पष्ट है कि नाभिक के घन विद्युत् का मान परमाणु में विद्यमान इलेक्ट्रॉनों की संख्या झ् के बराबर होगा। यह संख्या झ् ही अब परमाणुक्रमांक कहलाती है।
बोर का सिद्धांत (Bohr's Theory) - अब प्रश्न यह था कि ये इलेक्ट्रॉन वैद्युत् आकर्षण के कारण जाकर नाभिक में मिल क्यों नहीं जाते। इसका उत्तर बोर (Bohr) ने १९१३ ई. में यह दिशा कि परमाणु में इलैक्ट्रॉन बड़े वेग से नाभिक की परिक्रमा करते रहते हैं, ठीक उसी तरह जिस तरह सौरजगत् में ग्रह सूर्य की परिक्रमा करते रहते हैं। उनके अपकेंद्रबल का वैद्युत् आकर्षणबल से संतुलन होने के कारण इलेक्ट्रॉन अपनी वृत्ताकार (या दीर्घवृत्ताकर) कक्षा में ही चक्कर लगाता रहता है। सौर जगत् के समान ही विभिन्न इलेक्ट्रॉनों की कक्षाएँ विभिन्न दूरियों पर होती हैं।
इस परिकल्पना में आपत्ति यह थी कि विद्युच्चुंबकीय नियमों के अनुसार इस प्रकार घूमनेवाले इलैक्ट्रॉन के कारण विद्युच्चुंबकीय तरंग उत्पन्न होगी और उसके साथ कुछ ऊर्जा भी चली जायगी। फलत: इलेक्ट्रॉन की ऊर्जा बराबर घटती जायगी और इलेक्ट्रॉन क्रमश: नाभिक के निकट आता जाएगा और अंत में उसमें गिरकर विलीन हो जायगा, अर्थात् परमाणु स्थायी न रह सकेगा। इस आपत्ति के समाधान के लिये बोर ने प्लांक (Planck) की क्वांटम परिकल्पना (quantum hypothesis) का सहारा लिया। प्लांक ने १९०० ई. में ऊष्मा विकिरण के सबंध में इसका अत्यंत सफल उपयोग किया था। इसके अनुसार द्रव्य में से ऊर्जा का विकिरण ऊष्मा (अथवा प्रकाश) की तरंगों के रूप में चिरप्रतिष्ठित नियमानुसार सतत (continuous) रूप से नहीं होता, अर्थात् ऊर्जा अनंतत: अल्प परिमाण में निरंतर उत्सर्जित नहीं होती, वरन् अत्यल्प, किंतु परिमित, मात्रा के पुंजों में रह रहकर असंतत रूप से निकलती है। ऐसे ऊर्जापुंजों का नाम प्लांक ने क्वांटम (quantum) रखा था। इस असंततता के आधार पर बोर ने परमाणिवक इलेक्ट्रॉनकक्षाओं के लिये निम्नलिखित धारणाएँ बनाई :
hm = E1- E2 ......(३)
यदि तरंगदैर्ध्य l हो और प्रकाशवेग c हो तो m = c/l होगा, अत:
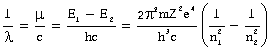 ......(४)
......(४)
परमाणु का रेखिल स्पेक्ट्रम (line spectrum) - बोर ने ये परिकल्पनाएँ मुख्यत: हाइड्रोजन स्पेक्ट्रम की रेखाओं की व्याख्या के लिये बनाई थीं और इस कार्य में उन्हें बड़ी सफलता मिली। यह तो बहुत वर्षों से ज्ञात था कि प्रत्येक तत्व के स्पैक्ट्रम में निश्चित तरंगदैर्ध्यवाली ऐसी रेखाएँ होती हैं जिनसे उस तत्व की पहचान हो सकती है। १८८३ ई. में बामर (Balmer) ने हाइड्रोजन की दृष्टिगम्य स्पेक्ट्रम रेखाओं के तरंगदैर्ध्यो में एक विलक्षण गणितीय संबंध का आविष्कार किया था। इसका आधुनिक रूप यह है :
![]() ......(५)
......(५)
हाइड्रोजन स्पेक्ट्रम की अन्य श्रेणियों के लिये इसका अधिक व्यापक सूत्र है :
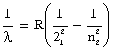 ......(६)
......(६)
इस सूत्र
में द१ और द२
तो पूर्ण संख्याएँ
हैं और ङ एक नियतांक
है, जो रिडवर्ग-नियतांक
(Rydberg constant) कहलाता
है। इसका मान
१,०९,६७८ है। इसमें और
बोर के उपर्युक्त
समीकरण (४) में
सादृश्य स्पष्ट है और
दोनों की तुलना
से प्रकट है कि
R=![]() होना चाहिए, क्योंकि
हाइड्रोजन के
लिये झ्उ १ है। इस सूत्र
में e, m, h, और
c के प्रयोगलब्ध
मानों को निविष्ट
करने से R
का मान १.०९´
१०५ प्राप्त होता
है। इस परिकलन
में स्पेक्ट्रम का
कुछ भी उपयोग
नहीं हुआ है, फिर
भी ङ के इस मान
से स्पेक्ट्रम द्वारा
प्राप्त मान की बराबरी
स्पष्ट है। यह बात
बोर के सिद्धांत
के पक्ष में बड़े महत्व
की है।
होना चाहिए, क्योंकि
हाइड्रोजन के
लिये झ्उ १ है। इस सूत्र
में e, m, h, और
c के प्रयोगलब्ध
मानों को निविष्ट
करने से R
का मान १.०९´
१०५ प्राप्त होता
है। इस परिकलन
में स्पेक्ट्रम का
कुछ भी उपयोग
नहीं हुआ है, फिर
भी ङ के इस मान
से स्पेक्ट्रम द्वारा
प्राप्त मान की बराबरी
स्पष्ट है। यह बात
बोर के सिद्धांत
के पक्ष में बड़े महत्व
की है।
इसके अतिरिक्त फ्रैंक और हर्ट्ज़ (Frank and Hertz) ने परमाणुओं तथा इलेक्ट्रानों की टक्करों का अध्ययन करके १९१४ ई. में स्थायी कक्षाओं का अस्तित्व प्रयोगात्मक रीति से भी प्रमाणित कर दिया है।
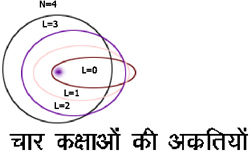
इसके बाद इलेक्ट्रॉन की दीर्घवृत्तीय कक्षाओं, स्पेक्ट्रम रेखाओं की बहुकरचना (multiplet structure) और सूक्ष्म रचना (Fine structure) तथा हाइड्रोजन के अतिरिक्त अन्य तत्वों के प्रकाशीय तथा एक्स-किरण-स्पेक्ट्रम आदि की व्याख्या भी थोड़े बहुत संशोधन के बाद वोर के सिद्धांत द्वारा, संतोषजनक रीति से हो गई और इस कार्य के लिये द के अतिरिक्त कई अन्य क्वांटम संख्याएँ १, त््र, द्म आदि की आवश्यकता हुई। १ क्वांटम भी पूर्ण संख्या ही होती है और प्रत्येक द के लिये १ के विभिन्न मान, ० से द- १ तक होते हैं। १उ द- १ वाली कक्षा वृत्ताकार होती है और ज्यों ज्यों १ घटता जाता है त्यों त्यों दीर्घवृत्तीय कक्षा का लघु अक्ष घटता जाता है। फलक के चित्र २. में दउ ४ की चार कक्षाओं की आकृति दिखाई गई है। इन सब के दीर्घ अक्ष बराबर होते हैं और ऊर्जा भी लगभग बराबर ही होती है।
इलेक्ट्रॉन
का चक्रण (Spin)
- १९२६ ई. में अहलनवेक
तथा गूडस्मिट (Uhlenbeck
and Goudsmit) ने यह बताया
कि परमाणु में
इलेक्ट्रॉन नाभिक
की प्ररिक्रमा करने
के साथ ही साथ
स्वयं अपने अक्ष पर
भी चक्रण करता
है, ठीक वैसे
ही जैसे पृथ्वी
सूर्य की परिक्रमा
भी करती है,
और अपने अक्ष पर
भी घूमती रहती
है। इस चक्रण का
संवेगघूर्ण प्रत्येक
इलेक्ट्रॉन के
लिये के![]() बराबर होता
है। इस परिकल्पना
के द्वारा स्पेक्ट्रम
संबंधी अनेक
कठिनाइयाँ दूर
हो गई और
स्पेक्ट्रम रेखाओं
पर चुंबकीय
क्षेत्र का ज़ेमान
प्रभाव (Zeeman
effect) भी पूर्ण रूप
से समझ में आ गया।
बराबर होता
है। इस परिकल्पना
के द्वारा स्पेक्ट्रम
संबंधी अनेक
कठिनाइयाँ दूर
हो गई और
स्पेक्ट्रम रेखाओं
पर चुंबकीय
क्षेत्र का ज़ेमान
प्रभाव (Zeeman
effect) भी पूर्ण रूप
से समझ में आ गया।
बोर परमाणु का व्यास - बोर के सिद्धांत के अनुसार परमाणु के व्यास का अर्थ है उसके बाह्यतम इलेक्ट्रॉन की कक्षा का व्यास। बोर के ऊपर लिखे सूत्र के अनुसार हाइड्रोजन परमाणु का न्यूनतम व्यास १०- ८ सेंमी. निकलता है, जो गत्यात्मक सिद्धांत द्वारा प्राप्त मान बराबर ही है। यह भी स्पष्ट है कि यह व्यास निश्चित मान का नहीं होता। बाह्य ऊर्जा के अवशोषण से अलेक्ट्रॉन कक्षा का द बढ़ जाता है और तब यह व्यास भी बढ़ जाता है।
इस सिद्धांत के अनुसार परमाणु अब ठोस अविभाज्य गोली नहीं समझा जा सकता। वह बिलकुल खोखला होता है। जिस प्रकार सौर जगत् में सूर्य तथा थोड़े से ग्रहों और उपग्रहों को छोड़कर सर्वत्र शून्याकाश ही है, ठीक उसी तरह परमाणु का भी प्राय: समस्त आयतन शून्याकाशमय है।
परमाणुओं की आवर्त सारणी (Periodic Table) - इसके सैद्धांतिक निर्वचन के लिये टॉमसन ने यह परिकल्पना बनाई थी कि परमाणु में इलेक्ट्रॉन विभिन्न परिच्छदों (shell) में अवस्थित रहते हैं। ये परिच्छद नाभिक से विभिन्न दूरियों पर होते हैं। सन् १९२३ में बोर ने इन परिच्छदों को क्वांटम संख्याओं (द) से संबद्ध कर दिया। प्रत्येक परिच्छेद के समस्त इलेक्ट्रॉनों की क्वांटम संख्या द का एक निश्चित मान होता है और उसमें कुछ उपपरिच्छद (subshell) भी होते हैं, जिनकी संख्या द के बराबर होती है। प्रत्येक उपपरिच्छद में क्वांटम संख्या १ का मान नियत रहता है। इन परिच्छदों और उपरिच्छदों में कितने कितने इलेक्ट्रॉन होते हैं? इनकी संख्या सीमित क्यों होती है? इन प्रश्नों का उत्तर पॉली (Pauli) ने १९२५ ई. में दिया था और सिद्धांतत: प्रमाणित कर दिया था कि (क) प्रत्येक १-क्वांटम उपपरिच्छद में इलेक्टॉनों की महत्तम संख्या २(21+ 1) होती है और (ख) प्रत्येक क्वांटम परिच्छेद में 2(21+ 1)= 2n2 होती है। यही आवर्त सारणी के विभिन्न आवर्तनों में क्रमश: २, ८, ८, १८, १८, ३२ तत्वों की उपस्थिति का कारण है। इन नियमों के अनुसार विभिन्न परमाणुओं की सरंचना नीचे दी हुई सारणी के अनुरूप होगी।
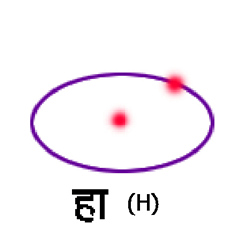
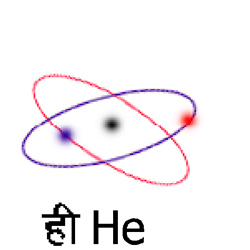
फलक के चित्र ३. में कुछ परमाणुओं के प्रतिरूप तथा परिच्छद सांकेतिक रूप में दिखाए गए हैं। सबसे अंदर के परिच्छद के इलेक्ट्रॉनों की कक्षाएँ पृथक् दिखाई गई हैं। ऐसा करना केवल यह स्मरण कराने के लिये है कि प्रत्येक परिच्छद में भी प्रत्येक इलेक्ट्रॉन की कक्षा पृथक् है। इस सारणी से स्पष्ट हो जायगा कि परमाणुओं में कुछ परिच्छद अथवा उपपरिच्छद तो इलेक्ट्रॉनों से संतृप्त हैं। उनमें और अधिक इलेक्ट्रॉन प्रवेश कर सकता है। इन बाह्य और असंतृप्त परिच्छदों के इलेक्ट्रॉनों पर ही परमाणु के रासायनिक गुण अवलंबित होते हैं। जिन परमाणुओं के बाह्य इलेक्ट्रॉन एक से होते हैं, उनके गुण भी एक से होते हैं। यही आवर्तत्व का कारण है। क्रमांक ३, ११, १९, ३७ के परमाणुओं में बाह्य इलेक्ट्रॉन केवल एक एक है। क्रमांक ४, १२, २०, ३८ में ऐसे इलेक्ट्रॉनों की संख्या दो दो है। इसी से इनके रासायनिक गुणों में समानता है। इन बाह्य इलेक्ट्रॉनों को संयोजक इलेक्ट्रॉन (valency electron) भी कहते हैं। इन्हीं पर परमाणु के स्पेक्ट्रमीय गुण भी निर्भर होते हैं। क्रमांक २, १०, १८, ३६ में परिच्छद संतृप्त हैं। इनमें न तो कोई इलेक्ट्रॉन आसानी से प्रवेश कर सकता है और न इनमें से कोई इलेक्ट्रॉन आसानी से बाहर निकल सकता है। अत: ऐसे परमाणु अधिक स्थायी और निष्क्रिय (inert) होते हैं। इनमें कोई संयोजक इलेक्ट्रॉन होता ही नहीं। क्रमांक ९ (फ्लो) (९(F)) और १७ (क्लो) (१७(Cl)) ऐसे परमाणु हैं जिनके परिच्छेदों को संतृप्त होने में एक एक इलेक्ट्रॉन की कमी है।
इसका कारण यह है कि जिस परमाणु में से एक इलेक्ट्रॉन आसानी से निकल सकता है, यथा सो (ग़्a) क्रमांक ११, वह एक इलेक्ट्रॉन की कमीवाले परमाणु, यथा क्लो (क्थ्) क्रमांक १७ से तुरंत संयोजित हो जाता है। इलेक्ट्रॉन निकलने से सो (Na) पर धन आवेश हो जाता है। और इलेक्ट्रॉन के प्रवेश से क्लो (क्थ्) पर ऋण आवेश हो जाता है। अत: दोनों में वैद्युत आकर्षण होता है और दोनों जुड़ जाते हैं। इससे सोक्लो (ग़्aक्थ्) का अणु वन जाता है। इसी प्रकार समस्त रासायनिक क्रियाएँ वैद्युत बलों के कारण होती हैं।
नवीन सिद्धांत - यद्यपि परमाणु की उपर्युक्त प्रकार को संरचना के द्वारा अनेक गुणों की अच्छी व्याख्या हो जाती है, तथापि बारीकी से देखने पर कई बातें ऐसी भी रह जाती हैं जिनकी व्याख्या इससे संभव नहीं। अत: नवीन सिद्धांतों की उद्भावना आवश्यक हा गई। और गतिविज्ञान अथवा यांत्रिकी (्थ्रड्ढड़ण्aदत्ड़द्म) को दो नवीन रूप दिए गए। एक तो है तरंगयांत्रिकी (Wave mechanics), जिसका विकास द ब्रॉगली (De Broglie) ने सन् १९२३ में प्रारंभ किया था तथा श्रेडिंगर (Schrodinger) ने जिसे अत्यंत उपयोगी रूप में प्रस्तुत किया था। दूसरा है क्वांटम यांत्रिकी (Quantum mechanics), जिसका प्रतिपादन हाइज़ेनबेर्ख (Heisenberg) ने सन् १९२५ में किया था (देखें क्वांटम यांत्रिकी)। इन्हीं दोनों के कारण बोर द्वारा प्रतिपादित परमाणु के प्रतिरूप की वास्तविकता पर से विश्वास उठ गया। प्रथम में तो इलेक्ट्रॉन ही तरंगरूपी माना गया है, जिसको किसी एक बिंदु पर अब स्थित नहीं माना जा सकता। फलत: इलेक्ट्रॉन कक्षाओं की धारणा अवास्तविक हो गई। दूसरे सिद्धांत में इलेक्ट्रॉन के स्थान, वेग आदि अप्रेक्षणीय राशियों का व्यवहार ही वर्जित है और केवल उन्हीं राशियों का उपयोग किया जाता है, जो प्रेक्षणगम्य हों। किंतु यद्यपि अब परमाणु का कोई साधारण अनुभवसंगत प्रतिरूप हम प्रस्तुत नहीं कर सकते तथापि उसकी विभिन्न ऊर्जावाली स्थावर स्थितियों के संबंध में कोई संदेह नहीं है। इन सिद्धांतों के द्वारा परमाणु संबंधी उन सभी ज्ञात बातों का स्पष्टीकरण संभव हो गया है जो बोर के सिद्धांत द्वारा समझ में नहीं आ सकी थीं।
समस्थानिक (Isotopes) - ऊपर बताया जा चुका है कि प्रत्येक परमाणु में एक अत्यंत छोटा सा नाभिक होता है, जिसके धन आवेश के अनुरूप ही अलेक्ट्रॉनों की संख्या होती है और तदनुरूप ही उस परमाणु के रासायनिक गुण होते हैं। यह नाभिक दो प्रकार की मौलिक कणिकाओं द्वारा संगठित होता है : प्रोटोन (proton) तथा न्यूट्रान (neutron)। दोनों का भार प्राय: हाइड्रोजन परमाणु के बराबर ही होता है। प्रोटॉन पर धन आवेश होता है, किंतु न्यूट्रॉन अनाविष्ट होता है। नाभिक में न्यूट्रॉनों की संख्या तो परमाणु क्रमांक झ् के बराबर होती है, किंतु यदि परमाणु भार ॠ हो तो स्पष्ट है कि न्यूट्रॉनों की संख्या A-Z होगी। यह भी स्पष्ट है कि न्यूट्रॉनों की संख्या में परिवर्तन होने से परमाणु के इलेक्ट्रॉनों की संख्या नहीं बदलती। अत: उसके रासायनिक गुण भी नहीं बदल सकते, परंतु उसका भार भारों के पूर्णसंख्यक होने का कारण है। पिछले कुछ वर्षों में तो नाभिकों पर न्यूट्रॉन आदि कणिकाओं की टक्करें मारकर उन तत्वों के समस्थानिक भी कृत्रिम रूप से प्राप्त कर लिए गए हैं जिनकी प्राकृतिक अवस्था में ये नहीं पाए जाते।
तत्वांतरण (Transmutation) - यूरेनियम, थोरियम, रेडियम जैसे अधिक भारवाले परमाणुओं के नाभिक स्वभावत: अस्थायी होते हैं। उनमें से अत्यंत तीव्रगामी धन-आविष्ट ऐल्फा कण (alpha particles), ऋण आविष्ट बीटा कण (beta particles) और एक्स किरणों से भी अधिक वेधनशल गामा किरणों (ढ़a्थ्र्थ्रa द्धaन्र्द्म) निरंतर निकलती रहती हैं। इस घटना को स्वोत्सर्जिता या रेडियमधर्मिता (Radioactivity) कहते हैं। इसमें परमाणु का नाभिक टूट जाता है, उसके क्रमांक में परिवर्तन हो जाता है और रासायनिक गुण बदल जाते हैं। वह बिलकुल दूसरा ही परमाणु बन जाता है। इस क्रिया को तत्वांतरण कहते हैं। इस प्राकृतिक तत्वांतरण के अतिरिक्त अब नाभिक पर न्यूट्रॉन के आघात से यह तत्वांतरण कृत्रिम रूप से भी संभव हो गया है और यूरेनियम से अधिक भारी परमाणु भी कृत्रिम उपायों से बना लिए गए हैं।
उपर्युक्त तत्वांतरण में तो परमाणु में से एक छोटा सा ही टुकड़ा पृथक् होता है, किंतु अब ऐसे भी उपाय निकल आए हैं जिनसे परमाणु के लगभग बराबर के दो टुकड़े किए जा सकते हैं। इसे विखंडन (fission) कहते हैं, यथा यूरेनियम परमाणु (भारउ २३५) को तोड़कर वेरियम और क्रिप्टन (भार क्रमश: १३७ और ८३) प्राप्त किए जा सकते हैं। इससे विपरीत क्रिया भी अत्यंत उच्च ताप पर संभव हो गई है, जिसे संलयन (fusion) कहते हैं। इसमें कई हलके नाभिकों को मिलाकर एक भारी नाभिक प्राप्त किया जा सकता है। यथा चार हाइड्रोजन नाभिक मिलकर एक हीलियम नाभिक बन जाता है। इन दोनों ही क्रियाओं से प्रचुर मात्रा में ऊर्जा प्राप्त होती है, जिसे परमाण्विक ऊर्जा कहते हैं। परमाणु बम में विखंडन का तथा हाइड्रोजन बम में संलयन का उपयोग होता है। बिजली बनाने के कारखानों में भी कोयले आदि ईधंनों के बदले अब इन्हीं क्रियाओं से ऊर्जा प्राप्त कर ली जाती है। संभवत: सूर्य की ऊष्मा भी संलयन द्वारा ही उत्पन्न होती रहती है।
प्राचीन काल में कीमियागरों का दावा था कि ताँबे, अथवा लोहे को, सोने में परिवर्तित कर सकते थे। सुना जाता है, पारस पत्थर भी लोहे को सोना बना सकता है। यद्यपि इन बातों का कोई प्रायोगिक प्रमाण नहीं है, तथापि तत्वांतरण की अनेक घटनाओं का प्रत्यक्ष अनुभव हो जाने से अब यह बात असंभव नहीं कही जा सकती।
सं.ग्रं.- बोर (Bohr) : दि थियरी ऑव स्पेक्ट्रा ऐंड ऐटॉमिक कॉन्स्टिट्यूशन (१९२२); सेजविक : दि इलेक्ट्रॉनिक थियरी ऑव वैलेंसी (१९२९); पॉलिंग तथा गूडस्मिट : दि स्ट्रक्चर ऑव लाइन स्पेक्ट्रा (१९३०); सॉमरफेल्ड : ऐटॉमिक स्ट्रक्चर ऐंड स्पेक्ट्रल लाइन्स; हर्ज़वर्ग (Herzberg) : ऐटॉमिक स्पेक्ट्रा ऐंड ऐटॉकिम स्ट्रक्चर (१९३७)।
(निहालकरण सेठी)