जल
पदार्थ की तीनों
दशाओं- ठोस,
द्रव और गैस-
में पाया जानेवाला
ऑक्सीजन और
हाइड्रोजन का
यौगिक हा२औ
(H2O)
है। संसार में
पाए जानेवाले
सभी जैव पदार्थों
में यह विद्यमान
है और पृथ्वी
का तीन चौथाई
धरातल जल से
घिरा हुआ है।
बहुत से मणिभों
की आकृति उनमें
उपस्थित जल पर
निर्भर करती
है। वर्षा, नदी,
झरने, झील, समुद्र,
कुएँ जल के प्रधान
स्त्रोत हैं। शताब्दियों
से भारतीय तथा
पाश्चात्य वैज्ञानिक
एवं विद्वान् इसे
तत्व स्वीकार करते
आए थे और उन तत्वों
में इसे एक मानते
थे जिससे इस संसार
की सृष्टि हुई
है। किंतु १७८३ ई. में
लाब्वाज़्ये ने सर्वप्रथम
यह सिद्ध किया
कि यह यौगिक
है, तत्व नहीं। गेलूसाक
(Gay-Lussac)
ने प्रमाणित किया
कि ऑक्सीजन का
एक आयतन हाइड्रोजन
के दो आयतन
से मिलकर जल
बनाता है। इन
दोनों गैसों
का संयोग ३००°
सें. पर बहुत मंद
होता है, किंतु
५५०° सें. पर
इनकी संयोजन
गति बढ़ जाती
है। विद्युद्विश्लेषण
से ऑक्सीजन ओर
हाइड्रोजन पृथक्
हो जाते हैं। जल
के अणु त्रिभुजाकार
हैं 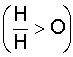 और
बांड कोण १०४.३९°
है। जल के एक अणु
का अर्धव्यास १.३८ एंग्स्ट्रौम
(Angstrom)
तथा औ-
हा (O-
H) दूरी
०.९९ एंस्ट्रीम है। हाइड्रोजन
परमाणु ऑक्सीजन
में इतने गहन रूप
से अंतर्भूत होते
हैं कि जल का अणु
लगभग गोलाकार
हो जाता है।
और
बांड कोण १०४.३९°
है। जल के एक अणु
का अर्धव्यास १.३८ एंग्स्ट्रौम
(Angstrom)
तथा औ-
हा (O-
H) दूरी
०.९९ एंस्ट्रीम है। हाइड्रोजन
परमाणु ऑक्सीजन
में इतने गहन रूप
से अंतर्भूत होते
हैं कि जल का अणु
लगभग गोलाकार
हो जाता है।
विभिन्न स्त्रोतों
से प्राप्त होनेवाले
जल में साबुन
से झाग बनाने
की क्षमता भिन्न
भिन्न होती है।
जिस जल में सुगमता
से यथेष्ट झाग
बनता है, उसे मृदुजल
और जिसमें झाग
देर से या कम
बनता है, उसे कठोर
जल कहते हैं। जल
की कठोरता
उसमें उपस्थित मैग्नीशियम
और कैल्सियम
के लवणों के कारण
होती है, जो
जल के प्रवाहमार्ग
में रहने के कारण
उसमें घुल जाते
हैं। जिस जल में
कैल्सियम सल्फेट
घुला रहता है,
वह स्थायी कठोर
और जिसमें मैग्नीशियम
और कैल्सियम
के बाइकार्बोनेट
घुले रहते हैं,
वह अस्थायी कठोर
कहलाता है। स्थायी
कठोरता को
दूर करने के
लिये कठोर
जल में सोडियम
कार्बोनेट डालते
हैं जिससे कैल्सियम
कार्बोनेट अवक्षिप्त
होता है और
सोडियम सल्फेट
विलयन में घुला
रह जाता है और
जल मृदु हो जाता
है। अस्थायी कठोरता
को दूर करने
की निम्नलिखित
विधियाँ हैं।
- उबालने से जल
में विलेय मैग्नीशियम
और कैल्सियम
के बाइकार्बोनेट
अविलेय कार्बोनेट
में बदल जाते
हैं जिसे छानकर
पृथक् कर देने
पर जल मृदु
हो जाता है।
- क्लार्क विधि
(Clark's process)
में जल में चूने
का पानी (कैल्सियम
हाड्रॉक्साइड) मिला
देने से कैल्सियम
बाइकार्बोनेट
अविलेय कार्बोनेट
में परिवर्तित
हो जाता है,
जिसे छान कर
पृथक कर देने
पर जल मृदु
हो जाता है।
- आयन विनिमय
(Ion Exchange)
अभिक्रिया के द्वारा
भी जल मृदु किया
जा सकता है।
कारखानों
के वाष्पित्रों (boilers)
में उपयोग के
लिये बड़े पैमाने
पर जल के मृदुकरण
के अनेक यंत्र बने
हैं। इनमें स्थायी
और अस्थायी दोनों
प्रकार की कठोरता
दूर हो जाती
है। (देखें जनस्वास्थ्य
इंजीनियरी)।
भौतिक
गुण - शुद्ध
जल गंधहीन, स्वादहीन,
तथा पारदर्शक
द्रव है। इसकी स्थूल
परत का रंग
निलंबित अशुद्धियों
के कारण नीला
होता है। हिमनदी
जलधारा का रंग
निलंबित हरे
कैल्सियम कार्बोनेट
के कारण हरा
रहता है। पानी
का क्वथनांक मानक
दबाव पर १००°
सें. तथा हिमांक
०° सें. है। ४°
सें. पर इसका घनत्व
१ ग्राम प्रति घन सेंमी.
होता है जो
इसका सर्वाधिक
घनत्व है। विभिन्न
तापों पर इसका
आयतन भी भिन्न
भिन्न होता है,
जैसे ०° सें.
पर १.०००१२२, ४° सें.
पर १.००००००, १०° सें.
पर १.०००२६१, २०° सें.
पर १.००१७४१ और ३०°
सें. पर १.००४३१० घन संमी.।
इसका विंद्युदपार्य
स्थिरांक (dielectric
constant) ८० है जो
कि पानी के अणुओं
के द्वध्रुिव प्रकृति
के कारण होता
है। शुद्ध जल विद्युत
का कुचालक होता
है। ०° सें. पर
इसकी विद्युत् संवाहकता
०.०३८´ १०- ६
(ओम- १-सेंमी.)-
१से. है।-
६ २०° सें. पर
सकी संपीड्यता
(Compressibility)
४३´ १०- ६
घन सेंमी. प्रति
मेगाबार है।
१००° सें. पर
इसकी विशिष्ट उष्मा
१.००६४ कैलॉरी प्रति
ग्राम तथा गुप्त
ताप ५३९ कैलॉरी
प्रति ग्राम है। २०°
सें. पर इसका वर्तनांक
१.३३३० है। २५° सें.
तथा एक वायुदाब
पर पानी की
श्यानता (Viscosity)
८.९५ मिलिप्वॉज (Millipoise)
होती है किंतु
यह १००° सें. पर
०° सें. की अपेक्षा
आठ गुना कम हो
जाती है।
रासायनिक
गुण - जल
महत्वपूर्ण विलायक
है। इसमें सैकड़ों
ठोस, गैस, और
द्रव पदार्थ घुल
जाते हैं। जल में
ठोस और द्रव
की विलेयता
ताप बढ़ने पर
बढ़ जाती है, किंतु
गैस की विलेयता
इसी दशा में कम
हो जाती है।
०° सें. तथा
एक वयुमंडलीय
दाब पर १ घन सेंमी.
जल में कार्बन
डाइऑक्साइड १.७३, हाइड्रोजन
०.०२१, ऑक्सीजन ००२४, सल्फर
डाइऑक्साइड ७९.८, हाइड्रोजन
क्लोराइड ५०६ तथा
एथिलीन ०.२५ आयतन
घुलता है। जब
जल अतितप्त किया
जाता है तब यह
शीशे पर क्रिया
कर क्षार को
निकाल लेता
है और सिलिका
को छोड़ देता
है।
जल के
उत्प्रेरक गुण के
कारण इसके द्वारा
बहुत सी रासायनिक
क्रियाएँ संपन्न
होती हैं। पूर्णतया
शुष्क क्लोरिन
गैस धातुओं
को आक्रांत नहीं
करती और न
विरंजन ही करती
है। धातुओं पर
जंग भी बिना
जल के नहीं लगता।
पानी की अनुपस्थिति
में अनेक वस्तुओं
के साधारण गुण
भी बदल जाते
हैं, जैसे ब्रोमीन
का क्वथनांक ६३°
सें. हो गया। सी.
स्मिट ने बताया
कि वस्तुओं के बहुलकरूप
(polymeric form)
में संतुलन रखने
में जल उत्प्रेरक
का कार्य करता
है, किंतु जल की
अनुपस्थिति में
वस्तु में यह संतुलन
नहीं रहता जिसके
कारण उनमें असामान्य
भौतिक गुण
उत्पन्न हो जाते
हैं पर जल के मिलते
ही वस्तुएँ अपने
साधारण गुणों
को पुन: प्राप्त
कर लेती हैं।
जल के
अणुओं का विस्तार
लघु होने के
कारण ये आयनिक
मणिभों के जालको
(lattices)
में बैठ जाते हैं
और हाइड्रेट
बनाते हैं। बहुत
से यौगिक जल
के निश्चित अणुओं
से संयोग कर
हाइड्रेट बनाते
हैं, जैसे क्यूप्रिक
सल्फेट पेंटाहाइड्रेट
ता गं औ४ ५हा
औ२ (CuSO4
5H2O)। प्राय:
यौगिक के अणु
के प्रति जल का
आकर्षण बड़ा जटिल
होता है। उपर्युक्त
हाइड्रेट में जल
के चार अणु सल्फेट
के आयन के चारों
ओर समन्वित रहते
हैं और १२५°
सें. पर पृथक्
किए जा सकते हैं
किंतु जल का पाँचवाँ
अणु इतने दृढ़ रूप
से जुड़ा रहता
है कि २५०° सें.
ताप पर ही वह
सल्फेट आयन को
त्यागता है। सल्फयूरिक
अम्ल भी स्थायी हाइड्रेट
है, किंतु इसका
व्यवहार यह संकेत
करता है कि हाइड्रेट
में संतुलन गं
औ३ हा२ औ
(SO3 H2O)
और गं औ२
(औ हा)२ (SO2
(OH)२)
के रूप में रहता
है। प्राय: जल के
विलयन में आयन
हाइड्रेट रहते
हैं, जैसे हा+
(H+ )
या हा५ औ२
(H5O2+
)। ब्रोमिन
और क्लोरिन
के अतिरिक्त अन्य तत्वों
के हाइड्रेट नहीं
होते। कुछ लवणों
में हाइड्रेट मणिभीकरण
जल के रूप में रहते
हैं, जैसे बेरियम
क्लोराइड बे क्लो२.
२हा२औ (Ba
Cl2. 2H2O), मैग्नीशियम
सल्फेट मैग गं
औ४ ७हा२औ२
(Mg SO4 7H2O2)
इत्यादि। एक ही लवण
जल के विभिन्न
अणुओं से मिलकर
विभिन्न हाइड्रेट
बनाता है जैसे
ता गं औ४ ५हा२औ
(CuSO4 5H2O),
ता गं औ४ ३हा२
औ (CuSO4
3H2O) और
ता गं औ४ हा२
औ (CuSO4
H2O)। यदि
हाइड्रेट की वाष्पदाब
वायुमंडल की
वाष्पदाब से अधिक
होती है तो
लवण शुष्क और
भुरभुरा हो
जाता है। इस प्रक्रिया
को प्रस्फुटन (Efflorescence)
कहते हैं और
इसके विपरीत
जब लवण वायुमंडल
से जल शोषित
कर गीला हो
जाता है, तब इस
प्रक्रिया को प्रक्लेदन
(Deliquescence)
कहते हैं। जल की
वह अभिक्रिया जिसमें
हाइड्रोजन उत्पन्न
नहीं होता जलविश्लेषण
(Hydrolysis)
कहलाती है।
धातुएँ
और कुछ अधातुएँ
जल या जलवाष्प
से ऑक्सीकृत
(Oxidised)
हो जाती हैं और
हाइड्रोजन स्वतंत्र
होकर निकल
जाता है, जैसे
३लो+ ४हा२
औ= लो३
औ४+ ४हा२
(3Fe+4H2O=Fe3O4+4H2)।
हैलोजन पर
जल वाष्प की अवकारक
क्रिया (reducing
action) होती
है, जैसे २क्लो२
+ २हा२ औ=
४हा क्लो+ औ२
(2Cl3+2H2O=4HCl+O2)।
कुछ तत्वों के साथ
जल की क्रिया से
असमानुपात (disproportion)
होता है, जैसे
३गं+ २हा२
औ= गं औ२+
२हा२ गं (3S+2H2O=SO2+2H2S)।
ऑक्साइड या हाइड्रेट
ऑक्सइड जल की अभिक्रिया
होने पर हाइड्रॉक्साइड
बनते हैं जो क्षारीय,
अम्लीय या उभयधर्मो
(amphoteric)
होते हैं। धात्विक
नाइट्राइड और
हाइड्राइड जल द्वारा
विघटित हो जाते
हैं जिससे हाइड्रोजन
और ऐमोनिया
गैस निकलती
है और धातु
के हाइड्रॉक्साइड
बनते हैं। जल से
मिलने पर धात्विक
कार्बाइड हाइड्रोकार्बन
बनाते हैं। जल
द्वारा वसा, अम्ल
और एल्कोहल में,
विश्लेषित हो
जाती है।
भारीपानी
- जब द्रव हाइड्रोजन
को वाष्पन के
लिये रख दिया
जाता है तब अवशेष
में बचे हुए हाइड्रोजन
समस्थानिक साधारण
हाइड्रोजन समस्थानिक
से दूने भारी
होते हैं। इस भारी
हाइड्रोजन समस्थानिक
को ड्यूटीरियम
कहते हैं। जो जल
इस ड्यूटीरियम
से बनाया जाता
है उसे भारी जल
या ड्यूटीरियम
ऑक्साइड (D2O)
कहते हैं जिसका
गुण साधारण
जल के गुण से
भिन्न होता है।
२५° सें. पर
इसका घनत्व १.१०६६ और
१०० ग्राम जल में नमक
की विलेयता
२९.७ ग्राम होती है।
इसका क्वथनांक
१०१.४२सें., हिमांक ३.८२सें.
तथा २०° सें.
पर श्यानता १,२६० मिलिप्वाज
होती है। ११.६°
सें. पर इसका घनत्व
सर्वधिक होता
है। रासायनिक
अभिक्रिया की दर
भारी पानी में
कम होती है।
विद्युदपार्य स्थिरांक
८०.७ तथा तलतनाव
साधारण जल
की तरह ही होता
है। नाभिकीय
अनुसंधान में
न्यूट्रान (Neutron)
की गति मंद करने
के लिये इसका
उपयोग किया
जाता है। साधारण
जल में भार के
अनुपात से ५,००० भाग
जल और एक भाग
ड्यूटीरियम ऑक्साइड
है, चाहे जल किसी
भी स्त्रोत से प्राप्त
किया गया हो।
मनुष्य के मूत्र
में भी ५०००:१ के अनुपात
में ही साधारण
और भारी पानी
मिलता है। यदि
मनुष्य ऐसे जल
का उपयोग करे
जिसमें भरी पानी
अनुपाम में अधिक
है तो मूत्र से
प्राप्त जल की मात्रा
से यह ज्ञात हो
जाता है कि भारी
जल की शरीर
से निकलने की
क्या गति है। किंतु
यह पाया गया
कि १५ दिनों के
पश्चात् भी आधे
से अधिक जल शरीर
में ही रह जाता
है।
आज की
वैज्ञानिक मीटरी
माप प्राणाली
जल पर आधारित
है। ४° सें. पर
१ घन सेंमी. जल का
भार १ ग्राम संहति
की इकाई है। इसी
प्रकार उष्माशक्ति
की इकाई कैलॉरी
ताप की वह मात्रा
है जो एक ग्राम
जल के ताप को
१° सें. (१४.५°
- १५.५° सें.)
बढ़ाने के लिए
आवश्यक होती
है। आपेक्षिक गुरुत्व
ज्ञात करने में
जल का ही उपयोग
किया जाता है।
किसी वस्तु का
आपेक्षिक गुरुत्व
उस वस्तु की मात्रा
और समान आयतनवाले
जल की मात्रा का
अनुपात होता
है। जल का क्वथनांक
(१००° सें.) प्रसामान्य
(normal)
दाब पर जल और
भाप के मध्य संतुलन
का ताप है और
इसी प्रकार जल
का हिमांक (०°
सें.) प्रसामान्य दाब
पर बर्फ और
वायु-संतृप्त
जल के मध्य संतुलन
का ताप है।
जल और
जीवन - जल
जीवन की प्राथमिक
आवश्यकता और
प्रोटोप्लाज्म का
महत्वपूर्ण अंश
है। वयस्क मनुष्य
में ६०% से लेकर
६३% तक, जेली
मछली में ९५%
तथा बीजों में
१०% तक जल पाया
जाता है। उपापचयन
(metabolism)
की प्रक्रिया के
लिये यह आवश्यक
वस्तु है। इसका विलायक
तथा गतिशीलता
का महत्वपूर्ण
गुण शरीर में
क्रमश: पोषक पदार्थ
को पहुँचने
तथा उत्सर्जित पदार्थों
को बाहर निकालने
में सहायक होता
है। प्रोटीन के
प्रत्येक अणु में जल
के प्राय: २,००० अणु उपस्थित
रहते हैं।
खनिज जल -
जब धरातलीय
जल लोहा, लिथियम,
गंधक तथा अन्य खनिजवाली
चट्टानों में
अंत: स्त्रवण करता
है तब खनिज जल
बनता है। यह जल
सोतों तथा झीलों
के रूप में प्राप्त
होता है। प्राकृतिक
चिकित्सा में इस
खनिज जल का प्रचुर
उपयोग होता
है। (अजित नारायण
महरोत्रा)
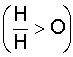 और
बांड कोण १०४.३९°
है। जल के एक अणु
का अर्धव्यास १.३८ एंग्स्ट्रौम
(Angstrom)
तथा औ-
हा (O-
H) दूरी
०.९९ एंस्ट्रीम है। हाइड्रोजन
परमाणु ऑक्सीजन
में इतने गहन रूप
से अंतर्भूत होते
हैं कि जल का अणु
लगभग गोलाकार
हो जाता है।
और
बांड कोण १०४.३९°
है। जल के एक अणु
का अर्धव्यास १.३८ एंग्स्ट्रौम
(Angstrom)
तथा औ-
हा (O-
H) दूरी
०.९९ एंस्ट्रीम है। हाइड्रोजन
परमाणु ऑक्सीजन
में इतने गहन रूप
से अंतर्भूत होते
हैं कि जल का अणु
लगभग गोलाकार
हो जाता है।