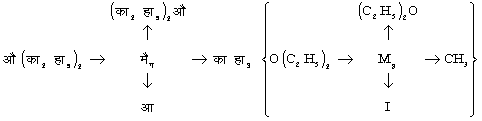
ग्रीनयार्ड के अभिकर्मक (Grignard Reagents) मैग्नीशियम के धात्वीय कार्बनिक यौगिक हैं, जो अपने आविष्कर्ता विक्टर ग्रीनयार्ड (Victor Grignard) के नाम पर 'ग्रीनयार्ड अभिकर्मक' कहलाते हैं। अन्य कार्बनिक यौगिकों के संश्लेषण में इनका बहुत ही महत्वपूर्ण स्थान है। यशद (Zinc) के कार्बनिक यौगिकों की सर्वप्रथम गवेषणा वैज्ञानिक एडवर्ड फ्रैंकलैंड (Edward Frankland) ने सन् १८४९ में की थी और इसके ५० वर्षों बाद सन् १८९९ में बारबियर (Barbier) ने संश्लेषण क्रियाओं में यशद के स्थान पर मैग्नीशियम धातु की उपयोगिता प्रदर्शित की। अगले वर्ष, सन् १९०० में इनके विद्यार्थी ग्रीनयार्ड ने इस गवेषणा की अनेकानेक संभावनाओं की ओर रसायनज्ञों का ध्यान आकर्षित किया और उन्होंने प्रदर्शित किया कि शुष्क ईथर (Ether) की उपस्थिति में मैग्नीशियम अनेक कार्बनिक हैलोजन यौगिकों में विलीन होकर एक नई श्रेणी के यौगिक बनाता है। इस क्रिया को, उदाहरण के लिये, निम्नांकित समीकरण द्वारा व्यक्त कर सकते हैं :
मू है + मैग ® मू मैग है
(R hal + Mg ® R Mg hal)
ऐलकिल या ऐरिल मैग्नीशियम ऐलकिल या ऐरिल
हैलाइड मैग्नीशियम हैलाइड
(R=radical=मू= मूलक; hal=halide=है= हैलाइड)
इन ऐलकिल या ऐरिल मैग्नीशियम हैलाइड यैगिकों की क्रियाशीलता तथा संश्लेषण क्रियाओं में इनकी उपयोगिता देखते हुए इन्हें ग्रीनयार्ड अभिकर्मक का नाम दिया गया है। इन अभिकर्मकों का महत्व इसी से स्पष्ट हो जाता है कि गवेषणा के प्रथम आठ वर्षों (सन् १९००-१९०८) में इनके ऊपर ८०० से अधिक अनुसंधान लेख प्रकाशित हुए और सन् १९१२ में विषय के महत्व को देखते हुए विक्टर ग्रीनयार्ड को नोबेल पुरस्कार द्वारा सम्मानित किया गया।
ग्रीनयार्ड अभिकर्मक साधारणत: स्वतंत्र अवस्था में नहीं पाए जाते और एक या दो ईथर अणुओं के संयोग में ही प्राप्त होते हैं। माइसेनहाइमर ने डाइएथिल ईथर में विलीन मेथिल आयोडाइड को मैग्नीशियम से अभिकृत करके प्राप्त यौगिक को निम्नलिखित सूत्र द्वारा व्यक्त किया :
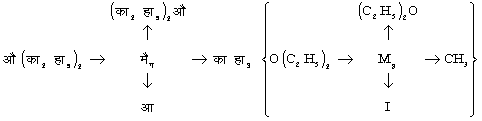
इसके विपरीत वैज्ञानिक शेलिनजेफ (Tschelinzeff) ने प्रदर्शित किया कि यदि साथ में ईथर की सूक्ष्म मात्रा भी उपस्थित हो तो ये अभिकर्मक बेंजीन, टॉलुईन तथा जाइलीन नामक विलायकों में भी प्राप्त किए जा सकते हैं। इन अवस्थाओं में प्राप्त ग्रीनयार्ड अभिकर्मक की मात्रा उपस्थित ईथर की मात्रा के अनुपात से कई गुनी तक अधिक हो सकती है, अतएव इससे यह निष्कर्ष निकलता है कि ईथर का कार्य केवल उत्प्रेरक का है।
विलयन से पृथक् होने पर ग्रीनयार्ड अभिकर्मक वायु में जलने लगते हैं, जिससे ठोस अवस्था में इनसे कार्य करना कठिन होता है। भाग्यवश कार्बोनिक संश्लेषण क्रियाओं में ग्रीनयार्ड अभिकर्मकों का ईथरीय विलयनों में ही सफलतापूर्वक उपयोग किया जा सकता है। इससे इनकी उपादेयता इतनी संभव हो पाई है। संश्लेषण में ग्रीनयार्ड अभिकर्मकों के उपयोगों को निम्नलिखित तीन मुख्य वर्गों में बाँटा जा सकता है :
(क) सक्रिय हाईड्रोजन वाले यैगिकों से अभिक्रिया - इस समूह के यौगिक, जैसे जल, ऐल्कोहल, ऐमिन आदि, ग्रीनयार्ड अभिकर्मकों से निम्नलिखित प्रकार की क्रिया करते हैं :
का हा३ मैग आ + मुऔहा = का हा४ + मूऔमैगआ
(C H3 Mg I + ROH = C H4 + ROMg I)
मेथाइल ऐल्कोहल मेथेन अभिकर्मक
मैग्नीशियम
आयोडाइड
शूगेफ (Tschugaeff) ने प्रदर्शित किया कि उपर्युक्त प्रकार की क्रियाओं से प्राप्त मेथेन की मात्रा नाप लेने पर कार्बनिक यौगिक में हाईड्रॉक्सिज़ समूहों की संख्या ज्ञात की जा सकती है। इसी प्रकार की क्रिया का उपयोग ऐमिन यौगिकों में ऐमिन समूहों की मात्रा या संख्या निर्धारित करने में किया जा सकता है। जल के साथ भी अभिक्रिया करके ग्रीनयार्ड अभिकर्मक विच्छेदित हो जाते हैं :
मूमैगआ + हाऔहा ® मू हा + मैग(औ हा)आ
(RMgI + HOH ® R H + Mg (OH) I)
हाइड्रोकार्बन
इसीलिये ग्रीनयार्ड अभिकर्मकों को बनाते या उपयोग करते समय सब विलायकों तथा अन्य यौगिकों को पूर्ण शुष्क अवस्था में लेना बहुत ही आवश्यक है।
(ख) असंतृप्त बंधता (unsaturated linkages) से योग अभिक्रिया (addition)- संश्लेषण के उपयोगों में ग्रीनयार्ड अभिकर्मकों की प्रमुख क्रिया यही है। इसमें ग्रीनयार्ड अभिकर्मक ऐल्डिहाइड (aldehyde), कीटोन (ketone) तथा नाइट्राइल (nitrile) आदि यौगिक समूहों के द्वि- या त्रि-बंधकों से योगशील (additive) यौगिक बनाते हैं और फिर इन योगशील यौगिकों पर अम्लों द्वारा अभिक्रिया करके विभिन्न क्रियाफल प्राप्त किए जा सकते हैं :
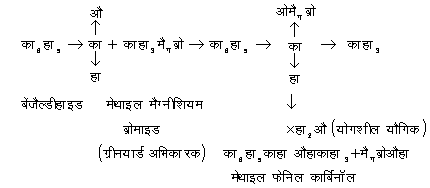
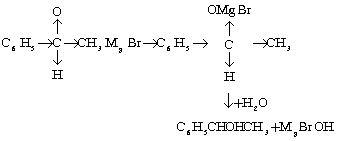
इसी प्रकार विभिन्न प्रकार के यौगिक संश्लेषित किए जा सकते हैं, जिनमें से कुछ के उदाहरण नीचे दिए जाते हैं :
फार्मैल्डीहाइड (formaldehyde) ® प्राथमिक ऐल्कोहल(primary alcohol)
अन्य ऐल्डीहाइड ® द्वितीयक (secondary) ऐल्कोहल
कीटोन (ketones) ® तृतीयक (tertiary) ऐल्कोहल
एस्टर (ester) ® तृतीयक ऐल्कोहल
आम्लिक क्लोराइड (acid chloride) ® कीटोन
नाइट्राइल (nitrile) ® कीटोन
(ग) स्वतंत्र मूलकों (free radicals) का बनना - वैज्ञानिक खराश (Kharasch) तथा उनके सहयोगियों ने पिछले वर्षों में प्रदर्शित किया है कि ग्रीनयार्ड अभिकर्मकों की क्रियाशीलता पर धात्वीय हैलाइडों, जैसे कोबाल्ट क्लोराइड, की उपस्थिति का बहुत प्रभाव पड़ता है। इस प्रभाव को समझाने के लिये विलयन में स्वतंत्र मूलकों की उत्पत्ति माननी पड़ती है। इस प्रकार की क्रियाओं का अच्छा उदाहरण कोबाल्ट क्लोराइड की उपस्थिति में फेनिल मैग्नीशियम ब्रोमाइड तथा फेनिल ब्रोमाइड से अच्छी मात्रा में डाइफेनिल बनना है :
को क्लो२
का६हा५मैगब्रो + का६हा५ब्रो = ® + का६हा५का६हा५ + मैगब्रो२
CoCl2
(C6H5MgBr + C6H5Br = ® + C6H5C6H5 + MgBr2)
फेनिल मैग्नीशियम फेनिल कोबाल्ट डाइफेनिल
ब्रोमाइड ब्रोमाइड क्लोराइड
उपर्युक्त वर्णन से विभिन्न प्रकार के कार्बनिक यौगिकों के संश्लेषण में ग्रीनयार्ड अभिकर्मकों की उपयोगिता स्पष्ट हो जाती है। इस विषय पर वैज्ञानिक साहित्य बहुत है और लगभग १५,००० अनुसंधान लेख प्रकाशित हो चुके हैं। (राम चरण मेहरोत्रा)