गैसों का द्रवण ऐतिहासिक विकास - पर्याप्त समय तक यह विचार प्रचलित रहा कि कोई भी वस्तु बरफ के ताप से और अधिक ठंड़ी नहीं हो सकती। फलत: बरफ के ताप को ही तापमिति का सबसे निचला बिंदु मान लिया गया। परंतु फारनहाइट ने सर्वप्रथम प्रदर्शित किया जा सकता है, जिसका मान - १८° तक हो सकता है। गैस सिद्धांतों के अध्ययन से यह स्पष्ट है कि, कम से कम सैद्धांतिक रूप में बरफ के गलनांक (melting point) से २७३° सें. कम ताप प्राप्त किया जा सकता है। इस - २७३° सें. ताप को 'ऐब्सोल्यूट ज़ीरो' अर्थात् परम शून्य कहते हैं।
सैद्धांतिक एवं प्रायोगिक, दोनों ही विचारों से, न्यूनतम ताप की उत्पत्ति का विशेष महत्व है। हवा को द्रवित करने के लिये बोरहेव (Boerhave) ने १७३२ ई. में सर्वप्रथम प्रयत्न किया, किंतु वह केवल हवा की नमी को ही द्रवित कर सका। इसके लगभग ७० वर्ष बाद फ़ूरक्रव (Fourcroy) और वॉक्लैं (Vauqvelin) ने - ४०° सें. ताप प्राप्त कर ऐमोनिया गैस के द्रवण में सफलता प्राप्त की। इन लोगों ने विभिन्न प्रकार के 'फ्रीज़िंग मिक्सचर्स' का उपयोग किया था। नार्थमूर (Northmore) १८०५ ई. ठंड़ एवं दाब के समकालीन प्रयोग से सल्फर डाइआक्साइ, क्लोरीन तथा हाइड्रोजन-क्लोराइड गैसों का द्रवण करने में सफल हुआ। बरफ बनाने की मशीन का आविष्कार सन् १७७५ में हुआ, परंतु इसका औद्योगिक उपयोग १८३४ ई. के पूर्व सफल न हुआ। फैरेडे (Faraday), कोलेडॉन (Colladon) और थिलोरियर (Thilorier) ने दाब के कारण गैसों के द्रवित हाने के सिद्धांतों पर कार्य किया। थिलोरियर ने ठोस कार्बन डाइ-आक्साइड एवं ईथर के 'फ्रीज़िंग मिक्सचर' का उपयोग भी किया और - ११०° सें. ताप प्राप्त किया। उन दिनों यह माना जाता था कि कुछ ही गैसों का द्रवण किया जा सकता है एवं हाइड्रोजन, नाइट्रोजन, आक्सीजन जैसी गैसें द्रवित नहीं हो सकतीं। इन गैसों को 'चिरस्थायी गैस' की उपाधि तक दे दी गई, यद्यपि कायते (Cailletet) और पिकटे (Pictet) १८७७ ई. में हाइड्रोजन, नाइट्रोजन तथा अक्सीजन गैसों के द्रवण में सफल हुए।
गैसों के द्रवण की विधियाँ - गैसों के द्रवण की विभिन्न प्रमुख विधियाँ निम्नलिखित हैं :
(१) कैसकेड-विधि (Cascade process) - इस विधि में गैस को पर्याप्त ठंड़ा किया जाता है और तब एक साथ ठंड़ एवं उच्च दाब का प्रयोग किया जाता है। परंतु ठंड़क उन विभिन्न द्रवों के उपयोग से प्राप्त की जाती है जिनका उबाल बिंदु (boiling point) क्रमानुसार कम होता जाता है। इसी कारण इस विधि को 'कैसकेड विधि' या 'सीरीज़ रेफ्रजरेशन' कहते हैं।

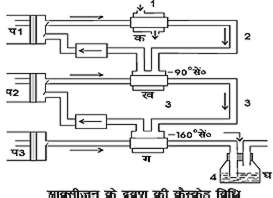
चित्र १. आक्सीजन के द्रवण की कैस्केड (Cascade) विधि क, ख और ग कंडेन्सर (condensers); प१, प२ तथा प३ विविध पंप (pumps); १. पानी; २. द्रव मेथाइल क्लोराइड; ३. द्रव एथिलीन तथा घ, द्रव आक्सीजन।
स्किरेट (१८७८ ई.) ने आक्सीजन को इस विधि से सर्वप्रथम द्रवित किया। व्रोब्लेव्स्की (Wroblewski) और ओलस्ज़ेव्स्की (Olszewski) ने इस विधि द्वारा काफी मात्रा में द्रव आक्सीजन, द्रव नाइट्रोजन एवं द्रव कार्बन डाइआक्साइड प्राप्त किया और इनके गुणों का अध्ययन किया। ओलस्ज़ेव्स्की ने अंतिम स्टेज में द्रव-इथिलीन का प्रयोग किया, जिससे वह उपर्युक्त गैसों को उनके 'क्रिटिकल ताप' (वह ताप जिसके नीचे दबाव देने पर गैस द्रवित हो जाती है) के नीचे तक ठंड़ा कर सका। कैमरलिंग ओन्स (Kamerlingh Onnes) ने मीथाइल-क्लोराइड और एथिलीन का उपयोग इस विधि में करके आक्सीजन का लगातार द्रवण किया। इसका उपयेग औद्योगिक स्तर पर भी किया गया।
कैमरलिंग ओन्स द्वारा उपयोग में लाया गया उपकरण चित्र १. में दिखलाया गया है। यह तीन पृथक् भागों में है, जिनमें प्रत्येक भाग एक 'कंप्रेशन पंप' और एक 'कंडेंसर' से बना है। पहले भाग में मेथाइल क्लोराइड द्रवित होती है। चूँकि मेथाइल क्लोराइड का 'क्रिटिकल ताप' १४३° सें. है, अत: यह सामान्य ताप पर ही थोड़े दबाव से द्रवित हो जाएगा। सिकुड़ी हुई मेथाइल-क्लोराइड गैस पंप प१ से कंडेन्सर क में ट्यूब द्वारा भेजी जाती है (जैसा चित्र से स्पष्ट है) तथा क के बाहरी जैकेट से ठंड़े पानी का परिभ्रमण कराया जाता है। इस प्रकार प्राप्त द्रव मेथाइल क्लोराइड दूसरे भाग के कंडेन्सर ख के जैकेट में परिभ्रमण करता है, जो प१ से संलग्न होता है, और इस तरह मेथाइल क्लोराइड (उबाल बिंदु - २४° सें.) बाष्प बनकर ख में - ९०° सें. तक ताप गिरा देता है। सिकुड़ा हुआ एथिलीन पंप प२ से ख के अंदर ट्यूब से भेजा जाता है। चूँकि इसका 'क्रांतिक ताप' १०° सें. है, ख में यह तुरंत द्रवित हो जाता है, क्योंकि ख - ९०° सें. पर द्रव मेथाइल क्लोराइड के परिभ्रमण से स्थिर है। ख से प्राप्त द्रव एथिलीन तीसरे भाग के कंडेंसर ग के जैकेट में परिभ्रमण करता है, जो प२ से संलग्न होता है और इस तरह एथिलीन (उबाल बिंदु - १०४ सें.) वाष्प बनक ग में - १६०° सें. तक ताप गिरा देता है। सिकुड़ी हुई आक्सीजन गैस पंप प३ से ग के अंदर ट्यूब में भेजी जाती है, जहाँ वह सरलता से द्रवित हो जाती है (क्रांतिक ताप - ११८° सें.)। तदुपरांत द्रव आक्सीजन डेवार बोतल (Dewar Flask) में एकत्रित कर लिया जाता है।
इसी विधि से हवा को भी द्रवित किया जा सकता है। इसके लिये हमें उपकरण का एक चौथा भाग प्रयोग में लाना पड़ेगा, जिसमें द्रव आक्सीजन हवा को उसके क्रांतिक ताप (- १४०° सें.) तक ठंड़ा करने में सहायता करेगा। परंतु नीयॉन (क्रांतिक ताप - २२९° सें.), हाइड्रोजन (क्रांतिक ताप - २४०° सें.) और हीलियम (क्रांतिक ताप - २६८° सें.) गैसें इस विधि द्वारा द्रवित नहीं की जा सकतीं, क्योंकि कोई भी द्रवित गैस इतना कम ताप, घटाए हुए दबाव में वाष्प होने पर भी, उत्पन्न नहीं कर सकती।
यह विधि थोड़ी कठिन होने के कारण इन दिनों अधिक उपयोग में नहीं लाई जाती।
(२) 'रिजेनरेटिव जूल-टामसन' विधि (Regenerative Joule Thomson Process) - इस विधि के सिद्धांत जूल-टामसन प्रभाव (Joule Thomson Effect) एवं रिजेनरेटिव कूलिंग (Regenerative Cooling) पर आधारित हैं। 'कैसकेड विधि' की अपेक्षा 'जूल-टामसन प्रभाव' के उपयोग से दो विशेष लाभ है : (१) गैस का उत्क्रमणांक (Inversion Temperature) तक ही ठंड़ा कर देना पर्याप्त है, जब कि 'कैसकेड विधि' के क्रांतिक ताप के नीचे तक ठंड़ा करना पड़ता है जो उत्क्रमणांक से बहुत नीचे होता है। २. 'कैसकेड विधि' की अपेक्षा बहुत कम पूर्वठंड़क आवश्यक होती है। फिर 'जूल-टामसन प्रभाव' द्वारा कम ठंड़ की प्राप्ति की मात्रा 'रिजेनरेटिव कूलिंग' से बढ़ा दी जाती है। पुनर्जनन सिद्धांत (Principle of Regeneration) का इस दिशा में सर्वप्रथम उपयेग लिंडे (Linde), हैंपसन (Hampson) और कई दूसरों ने किया।
लिंडे (१८९५ ई.) ने सर्वप्रथम इस विधि का उपयोग हवा के द्रवण के लिये किया। डेवार (Dewar) ने १८९८ ई. में इस विधि द्वारा हाइड्रोजन का द्रवण किया और कैमरलिंग ओन्स (१९०८ ई.) ने हीलियम का।
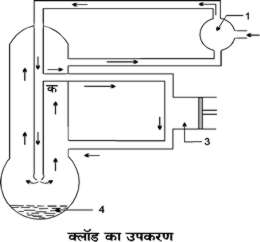
लिंडे का उपकरण चित्र २. में प्रदर्शित है। २०० 'ऐटमास्फीयरों' पर सिकुड़ी हुई हवा पानी द्वारा ठंड़ा किए हुए पाइप से भेजी जाती है, जहाँ पर सिकुडने से हवा का जो ताप बढ़ जाता है वह निकल जाता है। तदुपरांत सिकुड़ी हुई हवा ऐसी कुंडलाकार नली से भेजी जाती है जिसके अंतिम सिरे पर सूक्ष्म बहिद्वार होता है। हवा के सूक्ष्म बहिद्वार से बाहर आने में उसमें फैलाव होता है तथा उसका ताप गिर जाता है। यह ठंड़ी हवा अब ऊपर की ओर बढ़ती है और पुन: 'कंप्रेशन पंप' में चली जाती है। यह ठंड़ी हवा लगभग बाहरी दबाव पर ही होती है और मार्ग में कुंडलाकार नली के अंदर की हवा को ठंड़ी करती जाती है। बार बार सिकुड़ने एवं फैलने के कारण वह ताप प्राप्त हो जाता है जो हवा के द्रवण के लिये पर्याप्त होता है।

चित्र २. लिंडे का उपकरण
१. शीतक; २. ताजी हवा; ३. निपीड पंप; ४. निर्वात; ५. धार (Jet) तथा ६. द्रव वायु।
लिंडे का उपकरण तीन अश्वशक्ति के यंत्र से चालित था और उससे एक लिटर द्रव हवा प्रति घंटे प्राप्त होती थी।
(३) रुद्धोष्म प्रसरण विधि (Adiabatic Expansion Process) - यद्यपि जूल-टामसन प्रभाव पर आधारित द्रवणयंत्र विशेष उपयोग में हैं, फिर भी वे पूर्णतया संतोषजनक नहीं कहे जा सकते, क्योंकि उनकी क्षमता (efficiency) करीब १५% है। गैसों के रुद्धोष्म प्रसरण (गैस का वह फैलाव जिसमें न तो उष्मा बाहर से अंदर आने दी जाती है और न अंदर से बाहर) सिद्धांतों पर आधारित विधि निश्चित और प्रभावशाली सिद्ध हुई।
यों तो पिकटेट ने ही पहले 'कैसकेड विधि' से आक्सीजन का द्रवण किया था, परन्तु रुद्धोष्म (adiabatic) प्रसरण विधि से आक्सीजन का द्रवण कैलेरेट ने १८७७ ई. में किया।
रुद्धोष्म प्रसरण विधि सतत विधि नहीं थी। अत: इस विधि का उपयोग औद्योगिक स्तर पर तब तक नहीं हुआ जब तक क्लॉड (Claude) एवं हेलैंट (Heylandt) ने हवा के द्रवण के लिये नवीन विधि का विकास नहीं किया। सबसे बड़ी कठिनाई इस बात की थी कि कौन से स्नेहक का उपयोग मशीन के चलनेवाले हिस्सों में किया जाय, क्योंकि सभी साधारण स्नेहक संबद्ध तापों पर ठोस में परिवर्तित हो जाते थे। क्लॉड ने इस कठिनाई को पेट्रोलियम ईथर के उपयोग से दूर कर दिया, जो - १६०° सें. तक चिपचिपा रहता है।
क्लॉड का उपकरण चित्र ३. में प्रदर्शित है। सिकुड़ी हुई गैस एक पाइप से भेजी जाती है जो आगे चलकर क स्थान पर दो शाखाओं में विभक्त हो जाती है। गैस की कुछ मात्रा प्रसरण सिलिंडर पर कार्य करके उसे ढकेल देती है और स्वयं ठंड़ी हो जाती है। अब यह ठंड़ी गैस नीचे से ऊपर की ओर जाती है जिससे द्रवण कक्ष की नली में नीचे आती हुई गैस ठंढी होती जाती है। नली की यह गैस जब सूक्ष्म निकास द्वार पर निकलती है तब फैलती है और ठंड़ी होकर द्रवित हो जाती है। गैस की जो मात्रा द्रवित होने से बची रह जाती है वह पुन: संपीडन पंप में चली जाती है और इस प्रकार पूरी क्रिया बार बार दुहराई जाती है।
चित्र ३. क्लॉड (Claude) का उपकरण
१. निपीड पंप; २. गैस का प्रवेश; ३. यहाँ गैस फैलती तथा कार्य करती है; ४. द्रव गैस तथा क पर गैस दो शाखाओं में बँट जाती है।
सन् १९३४ ई. में कैपिज़ा (Kapitza) ने क्लॉड विधि से हीलियम एवं हाईड्रोजन का द्रवण किया। सन् १९४७ ई. में कॉलिन्स (Collins) के कैपिज़ा विधि द्वारा औद्योगिक रूप में हीलियम-द्रवण-मशीन तैयार की।
(४) रुद्धोष्म विचुंबकन विधि (Adiabatic Demagnetisation Process) - यह विधि परमशून्य ताप की प्राप्ति की दिशा में विशेष महत्वपूर्ण है। इस विधि के विकास के पूर्व निम्नतम प्राप्य ताप द्रव हीलियम एवं ठोस हीलियम के थे, जो क्रमश: प्राप्त किए गए थे। सन् १९२६ ई. में पीटर डेबाई (Peter Debye) ने सैद्धांतिक आधारों पर यह स्पष्ट कर दिया कि और भी निम्न ताप समचुंबकीय लवणों (paramagnetic salts) के रुद्धोष्म विचुंबकन द्वारा प्राप्त किया जा सकता है। किसी वस्तु को चुंबकीय शक्ति देने की क्रिया में उसका ताप कुछ बढ़ जाता है। अत: इसके विपरीत यदि कोई चुंबकीय वस्तु विचुंबकित की जाती है तो वह ठंड़ी हो जाती है।
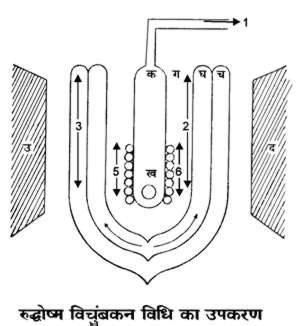
उपर्युक्त सैद्धांतिक भविष्यवाणी को १९३४ ई. में साइमन (Simon) एवं कुर्ती (Kurti), जिऑक (Giauque) एवं मैकडूगल (Mc Dougall) ने प्रमाणित कर दिखाया। इनका उपकरण चित्र ४. में प्रदर्शित है। समचुंबकीय (चुंबकीय क्षेत्र में चुंबकीय गुण रखनेवाली और चुंबकीय क्षेत्र हटा लेने के बाद चुंबकीय गुण खो देनेवाली) वस्तु ख (गैडोलिनियम सल्फेट) एक दीर्घवृत्तज अथवा गोले के आकार में ग्लास ट्यूब क में रखी जाती है, जो डेवार बोतलों ग, घ एवं च से घिरा होता है। इनमें द्रव हीलियम, द्रव हाइड्रोजन एवं द्रव हवा क्रमश: रहती हैं। यह पूरा समूह विद्युच्चुंबक के उत्तर दक्षिण सिरों के मध्य रख दिया जाता है।
१०,००० गौस (Gauss) के चुबंकीय फील्ड के अंदर वस्तु ख को चुंबकीय शक्ति दे दी जाती है। चुंबकत्व क्रिया में जो उष्मा उत्पन्न होती है उसे हाइड्रोजन गैस के बहाव से बाहर कर देते हैं। इसी बीच प्रायोगिक वस्तु द्रव हीलियम के ताप पर आ जाती है। तभी चुंबकीय क्षेत्र तोड़ दिया जाता है, जिसके कारण वस्तु ख का रुद्धोष्म विचुंबकन हो जाता है। प्रायोगिक वस्तु का ताप और गिर जाता है और वह द्रवित हो जाती है। रोचक बात तो यह है कि डे हास (De Haas) ने १९४४ ई. में विधि द्वारा ०.००२° K (केल्विन ताप) तक ताप प्राप्त कर लिया।
 चित्र
४. रुद्धोष्म विचुंबकन
विधि का उपकरण
चित्र
४. रुद्धोष्म विचुंबकन
विधि का उपकरण
द्रव गैसों की उपयोगिता - द्रव गैसों की प्रायोगिक उपयोगिता अपना विशेष महत्व रखती है। अत्यंत निम्न तापों की उत्पत्ति ने, जो द्रव हवा, द्रव हाइड्रोजन एवं द्रव हीलियम द्वारा प्राप्य है, वैज्ञानिक अनुसंधानों की एक नूतन एवं बृहत् शाखा खोल दी है। इस तथ्य ने इस बात की आवश्यकता बतलाई है कि प्रत्येक आधुनिक प्रयोगशाला में कम से कम एक द्रव-हवा यंत्र अवश्य रहना चाहिए। द्रव हवा की बोतलें अब अपेक्षाकृत कम मूल्यों पर एवं सरलता से उपलब्ध हैं।
द्रव हवा से आक्सीजन एवं विरल गैसों की प्राप्ति - हवा की प्रभाजी आसवन (fractional distillation) विधि, आक्सीजन को औद्योगिक रूप में प्राप्त करने की प्रमुख विधि है। चूँकि नाइट्रोजन का क्वथनांक - १९५° सें. है और आक्सीजन का - १८३° सें., अत: जो भाग सर्वप्रथम वाष्परूप में आता है उसमें नाइट्रोजन का बाहुल्य होता है। जो अंत में वाष्प रूप में आता है उसमें आक्सीजन का बाहुल्य होता है, अत: कुछ ही प्रभाजी आसवन की क्रियाओं से हवा के दोनों प्रमुख भाग पूर्णतया अलग हो जाएँगे।
इसी विधि से विरल गैसों (हीलियम, नियॉन, आर्गन) को भी प्राप्त किया गया है। द्रव हवा दो भागों में बाँटी जा सकती है : पहला अधिक वाष्पशील (हीलियम, हाइड्रोजन, नियॉन) और दूसरा कम वाष्पशील (आक्सीजन, आर्गन, कार्बन डाइआक्साइड, क्रिप्टॉन, ज़ेनॉन)। पहले भाग को द्रव हाइड्रोजन से ठंड़ा करने पर हाइड्रोजन के अलावा अन्य गैसें (हीलियम एवं नियॉन) पृथक् भाग में प्राप्त हो जाएँगी। इसी प्रकार हीलियम एवं नियॉन हवा से प्राप्त की जा सकती हैं।
उष्मामिति - डेवार ने वस्तुओं के कम ताप पर विशिष्ट उष्मा (Specific heat) के अनुसंधान के लिये द्रव हवा, द्रव आक्सीजन, द्रव हाइड्रोजन के उष्मामापियों का उपयोग किया। द्रव हाइड्रोजन के उष्मामापी द्रव ०.००३ कैलॉरी तक की उष्मामात्रा नापी जा सकती है।
उच्च निर्वात (high vacuum) की प्राप्ति - यह द्रव गैसों के उपयोग से हो सकती है। उदाहरण स्वरूप, यदि कोई बर्तन, जिसके भीतर हवा से कम वाष्पशील गैस (जैसे सल्फ़यूरस अम्ल या पानी का वाष्प) रखी हो, द्रव हवा से घिरा हुआ है तो अंदर की सभी गैस ठोस में परिवर्तित हो जायगी और इस तरह उच्च निर्वात की उत्पत्ति हो जाएगी।
ऊपरी वायुमंडल का अध्ययन - प्रयोगशाला में हम द्रव गैसों की सहायता से निम्न ताप प्राप्त कर सकते हैं, जो ऊपरी वायुमंडल सदृश स्थितियों से मिलते जुलते होंगे। इस तरह प्रयोगशाला में बैठे बैठे ऊपरी वायुमंडल का भी अध्ययन किया जा सकता है। (बेनी माधव शुक्ल.)