विसरण (Diffusion) सभी वस्तुएँ, ठोस, द्रव और गैसें, बड़े सूक्ष्म कणों से बनी हुई हैं। सबसे छोटे कणों को अणु (molecules) कहते हैं। अणु पदार्थों में सतत गतिशील रहते हैं। इनकी गतियाँ बहुत कुछ ताप पर भी निर्भर करती हैं। भिन्न भिन्न वस्तुओं को यदि एक साथ रखा जाए, तो इन गतियों के कारण वे परस्पर मिल जाती हैं। ठोसों के अणु एक दूसरे से बहुत निकटता से सटे हुए रहते हैं। द्रवों के अणु ठोसों के अणुओं की अपेक्षा कम सटे हुए रहते हैं। गैसों के अणु तो एक दूसरे से पर्याप्त दूरी पर रहते हैं, यही कारण है कि गैसें बड़ी शीघ्रता से एक दूसरे में मिल जाती हैं। द्रवों के अणु उतनी शीघ्रता से नहीं मिलते और ठोसों के अणु तो और देर से परस्पर मिलते हैं। इस प्रकार पदार्थों के अणुओं के परस्पर मिल जाने को विसरण कहते हैं। विसरण एक अपरिवर्तनीय क्रिया है, जिसमें पदार्थों के स्वाभाविक बहाव से सांद्रण का अंतर कम होता रहता है। यह क्रिया सभी पदार्थों में होती है। क्लोरीन गैस के जार पर यदि एक हवा भरा जार रख दिया जाए, तो क्लोरीन गैस के भारी होने पर भी उसके अणु विसरण द्वारा ऊपर उठकर दोनों जारों में मिल जाते हैं और कुछ समय में वे एक से संगठन के हो जाते हैं। यदि किसी जल के पात्र में तूतिया का एक क्रिस्टल रख दिया जाए, तो पहले क्रिस्टल के निकट का जल तूतिए के विलयन सा हो जाएगा और कुछ समय के बाद सारा जल तूतिए के रंग का हो जाएगा और कुछ समय के बाद सारा जल तूतिए के रंग का हो जाएगा। ऐसा विसरण के कारण होता है। यदि सोने के एक टुकड़े को सीस के टुकड़े के संपर्क में रखा जाए, तो कुछ दिनों के बाद सीस में सोना और सोने में सीस की उपस्थिति मालूम की जा सकती है। गुरुत्वाकर्षण से विसरण में कोई रुकावट नहीं पड़ती और न उत्प्लवकता का ही उसपर कोई प्रभाव पड़ता है।
गैसों का विसरण - गैसें शीघ्रता से विसरण करती हैं। हलकी गैसें, कम घनत्व के कारण, अधिक शीघ्रता से और भारी गैसें, अधिक घनत्व के कारण, कम शीघ्रता से विसरण करती हैं। इस संबंध में ग्राहम ने एक नियम जो 'ग्राहम के गैस विसरण के नियम' के नाम से विख्यात है, प्रतिपादित किया है। इस नियम के अनुसार समान दाव और ताप पर विसरण की गति गैसों के आपेक्षिक घनत्व के वर्गमूल का व्यूत्क्रमानुपाती होती है। यदि किसी गैस का आयतन V, T समय में विसरित होता है, तो गैस की विसरण गति V/T निम्नलिखित समीकरण से प्रदर्शित होती है :
![]()
जहाँ d1 और d2 दोनों गैसों के आपेक्षिक घनत्व हैं।
चूँकि 2d = M (अणुभार), अत:
उपर्युक्त =
![]()
गैसों के विसरण से हमें अनेक बड़े उपयोगी परिणाम प्राप्त होते हैं। इसकी सहायता से हम कुछ गैसों का आपेक्षिक घनत्व और इससे अणुभार निकाल सकते हैं तथा कुछ गैसों के मिश्रण से उनके संघटकों को अलग अलग कर सकते हैं। विसरण से कुछ गैसों के समस्थानिकों के पृथक्करण में हमें सफलता मिली है। कुछ जहरीली गैसें विसरण के कारण वायु में इतनी फैल जाती है कि उनसे हानि होने की संभावना बहुत कम हो जाती है। कार्बन डाइऑक्साइड गैस का वायु में एक निश्चित मात्रा से अधिक रहना स्वास्थ्य के लिए बहुत हानिकारक है। पृथ्वीतल पर ईधंन आदि से बना और साँस द्वारा निकला कार्बन डाइऑक्साइड भारी होने पर भी विसरण द्वारा समस्त वायु में ऐसा मिल जाता है कि उसके अनुपात में विशेष अंतर नहीं पाया जाता। कोयले की खानों में पाई जानेवाली दाह्य गैस, मार्श गैस, विसरण द्वारा ही समस्त खानों में फैल जाती है और उसके किसी एक स्थान की वायु के परीक्षण से इसका पता लग जाता है।
द्रवों का विसरण
- द्रवों का विसरण
गैसों के विसरण की अपेक्षा अधिक पेंचीदा है। इनका विसरण
बहुत कुछ पदार्थों की प्रकृति पर निर्भर करता है। सांद्रण और
ताप की वृद्धि से विसरण अपेक्षया सरल होता है। मान लें, किसी
पात्र में रखे विलयन का सांद्रण c
है और इसके सांद्रण की ऊर्ध्वाधर दिशा x
है। यदि सांद्रण प्रवणता (तल के लंब कोण पर मापित x
दूरी पर सांद्रण में परिवर्तन) ![]() श्है,
तब तल के एकक क्षेत्र को पार करती हुई विलेय वस्तु का
द्रव्यमान होगा
श्है,
तब तल के एकक क्षेत्र को पार करती हुई विलेय वस्तु का
द्रव्यमान होगा ![]() , जहाँ D एक स्थायी गुणांक (विलयवस्तु
के विसरण का गुणांक) है। इस संबंध को फिक (Fick)
का नियम कहते हैं और इससे प्रकट होता है कि विसरण-धारा-घनत्व
सांद्रणप्रवणता के अनुपात में और समांतर होता है।
, जहाँ D एक स्थायी गुणांक (विलयवस्तु
के विसरण का गुणांक) है। इस संबंध को फिक (Fick)
का नियम कहते हैं और इससे प्रकट होता है कि विसरण-धारा-घनत्व
सांद्रणप्रवणता के अनुपात में और समांतर होता है।
यदि
दो तल A और B, dx
दूरी से पृथक् है और प्रत्येक का एकक क्षेत्र है, तब किसी समय
T
में A तल का सांद्रण c
है, तो B तल का सांद्रण ![]() श्होगा।
A
तलपर विलेय वस्तु का अंतर्वाह होगा
श्होगा।
A
तलपर विलेय वस्तु का अंतर्वाह होगा ![]() श्जब
कि B
तल पर का वहिर्वाह होगा
श्जब
कि B
तल पर का वहिर्वाह होगा 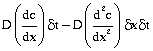 श्इस
पर A
और B के बीच के स्थल को प्रति सेकंड नेट
लाभ होगा
श्इस
पर A
और B के बीच के स्थल को प्रति सेकंड नेट
लाभ होगा 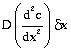 । चूँकि तलों
के बीच का परिबद्ध आयतन dx
है, सांद्रण का परिवर्तन है,
। चूँकि तलों
के बीच का परिबद्ध आयतन dx
है, सांद्रण का परिवर्तन है, 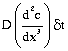 श्और
सांद्रण परिवर्तन की गति है।
श्और
सांद्रण परिवर्तन की गति है। ![]()
इसी समीकरण से विसरण प्रक्रिया का नियंत्रण होता है। यह फ़िक का दूसरा नियम है।
यदि
विलयन में विद्युत् से आवेशित कण नहीं है, तो D
का संबंध कणों की गतिशीलता (mobility)
B
से है और तब D=k T B जहाँ k
बोल्ट्समॉन का (Boltzmann's) स्थिरांक, T
परम ताप और B कणों की गतिशीलता
है। यदि कण r त्रिज्या के गोला (spheres)
है और विलायक के अणु से बड़े हैं, तो B
स्टोक (Stokes) के नियम से प्राप्त
होता है। इस नियम के अनुसार ![]() , जहाँ h
द्रव का श्यानता गुणांक है।
, जहाँ h
द्रव का श्यानता गुणांक है।
यदि विलयन कण विद्युत् से आवेशित हैं, तब D कणों के विभिन्न किस्मों पर निर्भर करता है। एकसंयोजक विद्युत् अपघट्य (electrolyte) विलयन, जिसमें दो आयन ही सोडियम और क्लोरीन हैं, जैसे नमक के विलयन में
![]()
जहाँ B1 और B2 दो आयनों की गतिशीलता है। इनसे विसरण गुणांक का आकलन हो सकता है और धुले कणों के विस्तार का निर्धारण किया जा सकता है। एक निश्चित परिस्थिति में मापन कर विसरण गुणांक का आकलन किया जा सकता है। विसरण गुणांक का प्रयोगों से निर्धारण कठिन इसलिए होता है कि द्रवों का विसरण बड़ी मंदगति से होता है। मापने योग्य परिवर्तन हो सके, इसमें हफ्तों या महीनों लग सकते हैं। इस समय विलयन ज्यों का त्यों बिना किसी विक्षोभ के रहना चाहिए। ऐसा होना कठिन काम है। इन कठिनाइयों के कारण ऐसे उपकरण की, जिसमें सांद्रण का बड़ा सूक्ष्म अंतर मापा जा सके, आवश्यकता पड़ती है। इसके लिए एक विशिष्ट प्रकार का कक्ष बना है, जिसमें सांद्रण का बड़ा सूक्ष्म अंतर मापा जा सकता है। इसमें सूक्ष्मदर्शी की सहायता ली जाती है। रंजक के विलयनों के विसरण मापने में ही उपयोगी सिद्ध हुआ है। रंजन की कार्यविधि और जैव तंतुओं के अभिरंजन के अध्ययन में भी यह कक्ष उपयोगी सिद्ध हुआ है।
विसरण गुणांक, D, का मान भिन्न भिन्न द्रवों के लिए बहुत भिन्न भिन्न होता है। यदि किस द्रव के विसरण गुणांक का मान बहुत ऊँचा है, तो ऐसे द्रव को हम क्रिस्टलाभ (Crystalloid) कहते हैं और जिसका विसरण गुणांक का मान कम रहता है, उसे कोलॉइड (Colloid) कहते हैं क्रिस्टलाभ, में अम्ल, लवण और अन्य वस्तुएँ आ जाती हैं, जो क्रिस्टलाभ बनती हैं और कोलॉइड में गोंद, ऐल्ब्युमेन, स्टार्च तथा सरस आते हैं। क्रिस्टलाभ साधारणतया पानी में घुलते हैं, जबकि कोलायड पानी में जेली बन जाते हैं। कोलॉइड के अणु बड़े जटिल (complex) होते हैं। इस कारण उनका विसरण गुणांक कम होता है। वे अपेक्षया स्वादहीन होते हैं, क्योंकि विसरित होकर तंत्रिका टर्मिनल (nerve terminal) तक नहीं पहुँच पाते। इसी कारण वे अपाच्य भी होते हैं। (विश्वनाथ त्रिपाठी)